
【题目】近年来,我国高铁飞速发展,已成为世界上唯一高铁成网运行的国家。请回答下列问题。
实验一 | 实验二 | 实验三 | |
实验操作 |
|
|
|
实验现象 | 蜡烛火焰___ | 软塑料瓶变瘪程度较大的是_(选填“甲”或“乙”) | 干石蕊纸花不变色, 湿石蕊纸花变红色 |
实验结论 | ①二氧化碳的密度比空气大; ②二氧化碳既不能燃烧,也不能支持燃烧 | 二氧化碳能与氢氧化钠发生反应 | _____ |
(1)制造高铁列车使用了多种材料。下列高铁列车的部件中,其主要材料属于金属材料的是_____(选填字母序号)。
A、玻璃车窗 B、镁铝合金车体
C、塑料小桌板 D、涤纶座套
(2)高铁电路多用铜质导线,这是利用了铜的延展性和__性。
(3)高铁刹车片由合金锻钢制作,时速300公里以上的列车紧急制动时,轮毂盘面和刹车片的温度瞬间达到 700℃以上,合金锻钢应该具备耐磨和__等特性。
(4)建造高铁需要消耗大量的铝、铁等金属。工业炼铁的原理是氧化铁(Fe2O3)和一氧 化碳在高温条件下反应,其化学方程式为_______。
(5)车身表面烤漆不仅美观,还能起到防锈的作用。其防锈的原理是_______。
(6)目前世界上已有 50%以上的铁得到了回收利用。回收利用废旧金属的社会意义是_____(写出一条即可)。
【答案】由下到上依次熄灭 乙 二氧化碳能与水反应 B 导电 耐高温 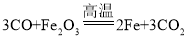 隔绝水和氧气 节约金属资源(合理即可)
隔绝水和氧气 节约金属资源(合理即可)
【解析】
实验一:由于二氧化碳既不能燃烧,也不能支持燃烧,且二氧化碳的密度比空气大。实验现象:蜡烛火焰由下到上依次熄灭;
实验二:实验现象:甲中50mL水溶解等体积的二氧化碳,瓶内气压减小程度低,乙中二氧化碳能与氢氧化钠发生反应,生成了碳酸钠和水,瓶中气压减小程度大,所以软塑料瓶变瘪程度较大的是乙;
实验三:实验现象:第1支试管中干石蕊纸花不变色,说明二氧化碳不能使干石蕊纸花不变色,第2支试管中,二氧化碳与湿石蕊纸花中的水反应产生碳酸,碳酸使湿石蕊纸花变红色,说明二氧化碳能与水反应;
(1)A、玻璃车窗,属于无机非金属材料,不符合题意;
B、镁铝合金车体,是金属材料,符合题意;
C、塑料小桌板,是合成材料,不符合题意;
D、涤纶座套,是合成材料,不符合题意。故选B。
(2)高铁电路多用铜质导线,这是利用了铜的延展性和导电性;
(3)列车紧急制动时,轮毂盘面和刹车片的温度瞬间达到700℃以上,合金锻钢应该具备耐磨和耐高温等特性;
(4)工业炼铁的原理是氧化铁(Fe2O3)和一氧 化碳在高温条件下反应,其化学方程式为: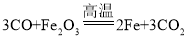 ;
;
(5)车身表面烤漆不仅美观,还能起到防锈的作用。其防锈的原理是隔绝水和氧气;
(6)金属矿物的储量有限,而且不可再生,我们必须保护金属资源并进行废旧金属的回收利用,回收利用废旧金属可以节约金属资源、节约冶炼金属所需的能源、能降低成本,减少环境污染等。


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:初中化学 来源: 题型:
【题目】如图1为实验室常用的实验装置。回答问题:
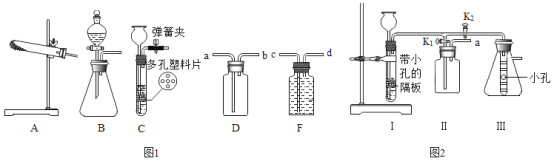
(1)写出用KClO3与MnO2制取O2的化学方程式:_______。若用A装置作为发生装置,还缺少______( 填仪器名称);若要收集较纯净的氧气,则应将气体从_____ (填“a”“b”“c" 或“d”)通入。
(2)实验室用锌粒与稀硫酸反应制取氢气,发生装置如C图所示。打开止水夹若发现稀硫酸未能与有孔塑料板上的锌粒接触,但此时已无稀硫酸可加,则下列溶液中最适宜从长颈漏斗中添加的________ (填字母)。
A 氢氧化钠溶液
B 碳酸钠溶液
C 硫酸钠溶液
D 澄清石灰水
(3)小明同学设计了如图2所示的实验装置,既可用于制取CO2,又可用于探究CO2的性质。说明:①装置I中盛放的药品是石灰石和稀盐酸。②装置Ⅲ中在小试管外璧贴有4片试纸,其中两端的两片用紫色石蕊溶液润湿,中间两片用紫色石蕊溶液浸过并哂干。实验时打开K1关闭K2可用来制取CO2。装置I的优点是____;若在II中放入_______________,还可用于检验CO2。实验时,关闭K1打开K2可用于探究CO2的性质。实验时III中出现的现象是__________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某同学向盛有Ca(OH)2溶液的烧杯中加入K2CO3溶液到一定量时停止了实验,烧杯中产生了白色沉淀,发生的化学反应方程式为_______。为了探究反应后液体的成分,用两支试管各取少量过滤后的滤液,继续做以下实验:
(1)向第一支试管的滤液中加入稀盐酸,有气泡产生,则滤液中的溶质是_______(填化学式)。
(2)向第二支试管的滤液中通入足量的CO2气体后,再蒸干滤液,得到白色固体,该物质在农业生产中的用途:_______(写一点即可)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙、丙三种固体物质的溶解度曲线如图1所示,请回答下列问题:
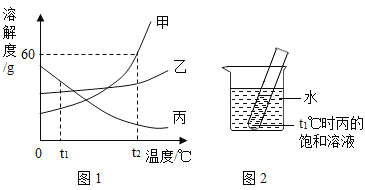
(1)t1℃时,甲、乙、丙三种物质中溶解度最大的是____。
(2)t2℃时,甲物质的溶解度为____g。
(3)将t2℃时的甲、乙、丙三种物质的饱和溶液降温至t1℃,所得溶液溶质质量分数由大到小的顺序为_______。
(4)如图2,t1℃时,若向烧杯中加入足量的_____(填字母序号)并使之充分溶解,在试管中可观察到有晶体析出。
A 氯化钠 B 氢氧化钠 C 硝酸铵
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某同学为验证镁、铁、铜、银的金属活动性顺序,设计了下图所示的四个实验(金属片均已打磨,且其形状大小相同;实验①②③所用盐酸的溶质质量分数和体积均相同)。下列分析不正确的是
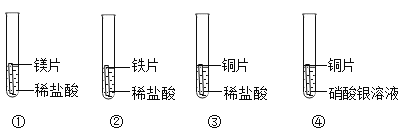
A.对比实验①②反应的剧烈程度,能判断出镁和铁的金属活动性强弱
B.分析实验②④的现象,能判断出铁、铜、银的金属活动性强弱
C.分析实验④的现象,能判断出铜和银的金属活动性强弱
D.分析四个实验的现象,能判断出镁、铁、铜、银的金属活动性顺序
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】2020年6月8日是第12个“世界海洋日”,海洋是巨大的资源宝库。某课题小组模拟工业海水提镁的流程,在实验室制取生产镁的原料——氯化镁,设计方案如下:
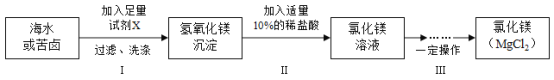
(信息)
(1)海水和苦卤中都含有NaCl、Na2SO4、MgCl2、CaCl2、KCl等。
(2)苦卤是海水晒盐后剩余的溶液。
(3)如下表是某品牌不同碱的价格。
试剂 | NaOH | Ca(OH)2 | Ba(OH)2 | KOH |
价格(元/吨) | 2400 | 850 | 5300 | 5500 |
请分析与计算。
(1)海水和苦卤都可以作为制取氯化镁的原料,甲同学提出选择苦卤更好,小组同学一致同意他的观点,理由是______。
(2)在工业生产中为了降低成本,试剂X最好选择表格中的______。
(3)该方案制取氯化镁时,要经历步骤I和步骤II两步转化,其主要目的是____。
(4)小组同学按上述方案进行了实验,并制得19.0g干燥纯净的氯化镁固体。若步骤Ⅱ中溶质质量分数为10%的稀盐酸与氢氧化镁恰好完全反应,且步骤III中氯化镁没有损失,求步骤II中消耗稀盐酸的质量___。(写出计算步骤)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】从氯碱工业产生的盐泥中回收BaSO4,其主要工艺流程如下图。
已知:①盐泥的主要成分为BaSO4、NaCl、Mg(OH)2和CaCO3。
②BaSO4难溶于水,不与盐酸反应。
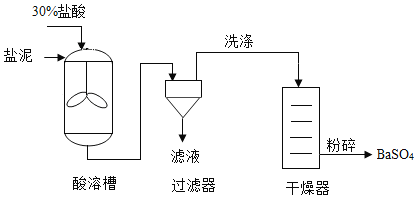
(1)除去NaCl,利用的性质是____。
(2)酸溶槽中发生中和反应的化学方程式为____。
(3)过滤器中分离出来的固体是____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com