【题目】A、B、C、D、E分别表示初中化学常见的五种物质,它们的部分反应和转化关系如图所示。( “![]() ”表示两种物质间能发生反应,“
”表示两种物质间能发生反应,“![]() ”表示一种物质能够转化为另一种物质,部分反应物或生成物以及反应条件已略去,不考虑微溶物)。C是盐,D是氧化物。
”表示一种物质能够转化为另一种物质,部分反应物或生成物以及反应条件已略去,不考虑微溶物)。C是盐,D是氧化物。
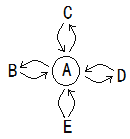
(1) 常温下,若A为一种气态氧化物,且A与B的相互转化能实现自然界中的碳氧循环, C可用于制玻璃,俗称纯碱,E是单质。A的固体俗称_____,C的化学式为__,D的用途_______(只说一点)。A转化为B的化学方程式_______。
(2) 若A为生活中使用最广泛的金属,且E不能转化为A,其它关系不变,C由两种元素组成,其溶液为浅绿色,E是无色溶液,与A、C反应时都能产生明显现象,D是黑色固体,B是一种气体单质,B与D可以反应生成A和水。
① 写出A![]() D的化学方程式:____________。
D的化学方程式:____________。
② B与D的反应属于_____________________ (填基本反应类型)
③ E 中溶质的化学式为_____________。
参考答案:
【答案】 干冰 Na2CO3 燃料或冶炼金属等 6CO2+6H2O![]() C6H12O6+6O2 3Fe+2O2点燃Fe3O4 置换反应 AgNO3
C6H12O6+6O2 3Fe+2O2点燃Fe3O4 置换反应 AgNO3
【解析】根据所学知识和题中信息知,(1) 常温下,若A为一种气态氧化物,且A与B的相互转化能实现自然界中的碳氧循环,A是二氧化碳,B是水,C可用于制玻璃,俗称纯碱,C是碳酸钠,D是一氧化碳,E是单质,E是碳。A是二氧化碳,二氧化碳的固体俗称干冰。C的化学式为Na2CO3,D的用途燃料或冶炼金属等。A转化为B的化学方程式为6CO2+6H2O![]() C6H12O6+6O2。(2) 若A为生活中使用最广泛的金属,A是铁,且E不能转化为A,其它关系不变,C由两种元素组成,其溶液为浅绿色,C是氯化亚铁,E是无色溶液,E是硝酸银,与A、C反应时都能产生明显现象,铁比银活泼,铁与硝酸银溶液反应置换出银,氯化亚铁与硝酸银溶液反应生成氯化银白色沉淀,D是黑色固体,D是四氧化三铁。B是一种气体单质,B与D可以反应生成A和水,B是氢气。① A
C6H12O6+6O2。(2) 若A为生活中使用最广泛的金属,A是铁,且E不能转化为A,其它关系不变,C由两种元素组成,其溶液为浅绿色,C是氯化亚铁,E是无色溶液,E是硝酸银,与A、C反应时都能产生明显现象,铁比银活泼,铁与硝酸银溶液反应置换出银,氯化亚铁与硝酸银溶液反应生成氯化银白色沉淀,D是黑色固体,D是四氧化三铁。B是一种气体单质,B与D可以反应生成A和水,B是氢气。① A![]() D的化学方程式是3Fe+2O2点燃Fe3O4。② B与D的反应属于置换反应,Fe3O4+4H2高温3Fe+4H2O,一种单质和一种化合物反应生成另一种单质和另一种化合物。③ E 中溶质的化学式为AgNO3。
D的化学方程式是3Fe+2O2点燃Fe3O4。② B与D的反应属于置换反应,Fe3O4+4H2高温3Fe+4H2O,一种单质和一种化合物反应生成另一种单质和另一种化合物。③ E 中溶质的化学式为AgNO3。
点睛∶掌握常见物质的性质和用途是顺利完成本题的重要保证。碳酸钠俗称纯碱,二氧化碳的固体俗称干冰。
-
科目: 来源: 题型:
查看答案和解析>>【题目】化学就在我们身边,请用所学的化学知识填空。
(1) 用化学符号和数字填空:
①人体中含量最多的元素是___________;②食醋中显酸性的阳离子是__________;
③极易与血红蛋白结合的有毒气体是____;④硫酸亚铁中铁元素的化合价是_____;
(2) 如图是某同学自制汽水的课外实验,请回答下列问题:
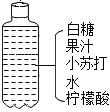
①柠檬酸pH ___________ 7(填““<”、“ =”或 “>”)
②装汽水的塑料瓶属于_______________材料;
③有关小苏打说法不正确的是________(填序号)
A.属于酸B.可做焙制糕点的发酵粉
C.能与柠檬酸反应产生二氧化碳 D.可用于治疗胃酸过多症
(3) 水是生命之源
①生活中既能降低水的硬度,又能杀菌消毒的方法是_____________________ ;
②含氮的物质进入水中会造成水中藻类大量繁殖,使水体富营养化导致水质恶化。这里的“氮”是指 __________________(填序号) 。
A.离子 B.原子 C. 元素 D.分子
③根据水电解的产物,可以推断出水的组成,依据是_____________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】化学是一门以实验为基础的学科,根据下图,回答问题。
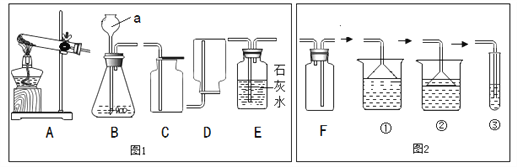
(1) a仪器的名称为______________;
(2) 实验室用A装置制O2的化学方程式为________,选用的收集装置是图1中的_______(填字母序号)。查阅资料后可知,锰酸钾可溶于水,若要从高锰酸钾完全分解后的固体残渣中回收二氧化锰,正确操作的顺序是___________(填写选项序号) 。
a.烘干 b.溶解 c.过滤 d.洗涤
(3) 用装置B制取CO2,反应的化学方程式为__________,通过装置B、E来验证二氧化碳的性质,实验过程中观察到E中有气泡冒出,但澄清的石灰水未变浑浊,试分析其可能的原因 ______。
(4) 氨气是一种无色、有刺激性气味的气体,密度比空气小,极易溶于水。实验室用加热氯化铵和氢氧化钙的固体混合物制取氨气,其反应的化学方程式为_________,收集氨气时最好选用F装置与______装置相连接 (填数字编号) 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验室现有氯化镁和硫酸钠的固体混合物样品,小明同学想测定样品中氯化镁的质量分数。先称取该混合物样品20g,完全溶于水中,然后取用了一定溶质质量分数的氢氧化钠溶液100g平均分四次加入其中,充分振荡,实验所得数据见下表,请你分析并进行有关计算:

(1)上表中X的数值为_________;
(2)计算原固体混合物样品中氯化镁的质量分数是_______?(请依据相关化学方程式进行计算,写出必要的过程)
(3)上述实验中所用到的氢氧化钠溶液,是小明同学利用实验室中已有的80g溶质质量分数为30%的氢氧化钠溶液现配制的,试计算需加入______克水,才能配成实验中所需溶质质量分数的氢氧化钠溶液?
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图为某医用葡萄糖注射液商标的一部分,下列说法不正确的是

A. 该葡萄糖注射液的溶质质量分数为5%
B. 100mL该葡萄糖注射液中溶质为5g
C. 在人体组织里,葡萄糖在酶的作用下经缓慢氧化转变成CO2 和H2O
D. 葡萄糖中碳元素、氢元素、氧元素的质量之比为1:2:1
-
科目: 来源: 题型:
查看答案和解析>>【题目】黄铁矿(主要成分为FeS2,杂质不含硫元素)是我国大多数硫酸厂制取硫酸的主要原料。现以黄铁矿为原料生产硫酸,工艺流程如图所示
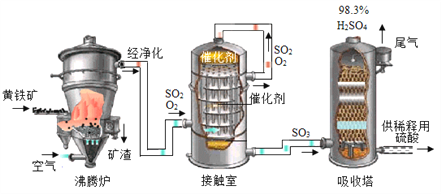
(查阅资料)

(1) 接触室中发生反应的化学方程式为________________。现将100g98%浓硫酸稀释成质量分数为10%的硫酸,需要水的质量是________g,稀释时,应将______沿烧杯内壁慢慢注入烧杯内液体中,并用玻璃棒不断搅拌。硫酸是一种重要的化工产,用途十分广泛,请写出稀硫酸的一种用途____________。
(2) 依据生产硫酸的工艺流程图,下列说法正确的是_____________(填字母).
A.为使黄铁矿充分燃烧,需将其粉碎 B.催化剂能够提高SO2的反应速率和产量
C.SO2可作为生产硫酸的原料再利用 D.沸腾炉排出的矿渣可供炼铁.
(3) 化学兴趣活动小组称取1.6g黄铁矿样品放入如下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全,最终B锥形瓶中增重1.28g.
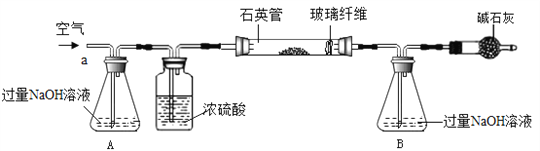
①A中NaOH溶液的作用____________________________。
②计算该黄铁矿中FeS2的质量分数___________。(假设每步反应均完全)
-
科目: 来源: 题型:
查看答案和解析>>【题目】某研究性学习小组对中和反应进行探究,请你参与实验
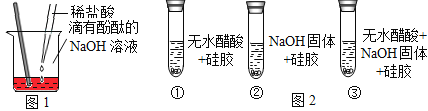
(探究活动1)证明酸和碱发生了反应小丽同学按图1进行实验,证明了盐酸和NaOH溶液能发生化学反应,他依据的实验现象是_______;反应的化学方程式________;玻璃棒的作用是_____。
(探究活动2)能否通过证明有水生成来证明其反应的发生?
(设计实验)小明同学取变色硅胶、无水醋酸和氢氧化钠固体进行如图2所示的三个实验。
(小资料)a.变色硅胶吸水后由蓝色变为红色;
b.无水醋酸是一种酸,常温下为无色液体;
(1)实验①、②的目的是____________________;
(2)加入试剂后,要迅速塞紧橡胶塞的原因是____________________;
(3)上述三支试管中能证明酸和碱反应有水生成的现象是_______________;
(4)除了上述方法之外,还可以按照下表实验方法证明稀盐酸与氢氧化钠发生了反应,说出对应的实验现象和实验结论:
实验步骤
实验现象
实验结论
取少量氢氧化钠溶液于试管中,加入过量稀盐酸,再加入少量氧化铜
_______
氢氧化钠和盐酸发生了反应
相关试题

