【题目】向100 g9.8%的稀硫酸中逐滴加入8%的氢氧化钠溶液至200g,测得硫酸的质量分数与加入的氢氧化钠溶液质量的关系如下图所示,计算回答:

(1)据上左图分析:加入氢氧化钠溶液______g时与100g稀硫酸恰好完全反应。
(2)计算坐标中a点相应的值是_______________?(写出计算过程,保留小数点后一位,下同)
(3)计算往稀硫酸中加入氢氧化钠溶液至200g时所得溶液中硫酸钠的质量分数___________?
参考答案:
【答案】 100 3.3% 4.7%
【解析】(1)当硫酸的质量分数为零时,硫酸与氢氧化钠恰好反应,由图所示可知,此时消耗100g氢氧化钠溶液。
(2)设加入50g氢氧化钠溶液时,参加反应的硫酸的质量为x。
2NaOH + H2SO4 == Na2SO4 + 2H2O
80 98
50g×8% x
![]() =
=![]() ,解得x=4.9g
,解得x=4.9g
坐标中a点相应的值是:![]() ×100%=3.3%
×100%=3.3%
(3)设当加入氢氧化钠溶液100g时,生成硫酸钠的质量为y。
2NaOH + H2SO4 == Na2SO4 + 2H2O
80 142
100g×8% y
![]() =
=![]() ,解得y=14.2g
,解得y=14.2g
故往稀硫酸中加入氢氧化钠溶液至200g时,所得溶液中硫酸钠的质量分数:![]() ×100%=4.7%
×100%=4.7%
-
科目: 来源: 题型:
查看答案和解析>>【题目】人类对材料的发现和使用经历了从石器、青铜器、铁器到铝的大规模使用等漫长的征程。请回答:
(1)我国是最早采用湿法冶铜的国家。文献记载“胆铜法”:用铁与“胆水”(含CuSO4)反应获得铜。铁与硫酸铜溶液反应的化学方程式为________;
(2)下列金属矿物中,可以用来炼铁的是______(填正确选项前的字母);
A. 赤铜矿(Cu2O) B.赤铁矿(Fe2O3) C.软锰矿(MnO2)
(3)生活中人们喜欢用铝制品的一个重要因素是它难生锈,铝制品难生锈原因是:______________。
(4)为比较铜和铁的金属活动性,某同学设计实验方案:将大小相同的铜块和铁块分别放入相同浓度的稀盐酸中,比较反应的剧烈程度。你认为该方案__________________(填“合理”或“不合理”),理由是_____________。
(5)我国的高铁技术世界领先.高铁钢轨采用铝和氧化铁在高温下发生置换反应实现无缝焊接,该反应的化学方程式为_____________.
-
科目: 来源: 题型:
查看答案和解析>>【题目】水钢采用烟气脱硫工艺,不仅能消除二氧化硫,防止形成酸雨,还能将其转化为硫酸钙等产品,实现“变废为宝”。反应的化学方程式为:2CaCO3+O2+2SO2
 2CaSO4+2CO2,现用2.5t含碳酸钙80%的石灰石吸收烟气中的二氧化硫。求:
2CaSO4+2CO2,现用2.5t含碳酸钙80%的石灰石吸收烟气中的二氧化硫。求:(l)所用石灰石中含碳酸钙的质量。
(2)理论上可吸收二氧化硫的质量(要求有计算步骤)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下表是Ca(OH)2和NaOH的溶解度数据。请回答下列问题:
温度/℃
0
20
40
60
80
100
溶解度/g
Ca(OH)2
0.19
0.17
0.14
0.12
0.09
0.08
NaOH
42
109
129
174
314
347
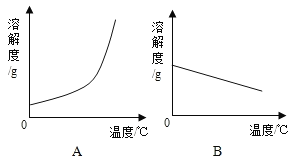
(1)依据上表数据,绘制Ca(OH)2和NaOH的溶解度曲线,下图中能表示Ca(OH)2溶解度曲线的是_______(填“A”或“B”)。
(2)要想把一瓶接近饱和的Ca(OH)2溶液变成饱和溶液,有下列措施:①加入氢氧化钙,②升高温度,③降低温度,④加入水,⑤蒸发水后再恢复到原温度。其中均可行的一组是______(填序号)
A.①②④ B.②③④ C.①③⑤ D.①②⑤
(3)20℃时,200g饱和NaOH溶液,蒸发10g水后,再恢复到20℃,可析出NaOH晶体的质量为________g。
(4)现有20℃时Ca(OH)2的饱和溶液(甲溶液),向其中加入一定量的CaO固体后,恢复到20℃,得到的溶液(乙溶液),已知:CaO + H2O = Ca(OH)2 。 则甲乙溶液中溶质的质量分数的关系为ω(乙)_____ω(甲)(填“>”、“<”或“=”)。
(5)现有60℃时含Ca(OH)2和NaOH两种溶质的饱和溶液,若要得到较纯净的NaOH晶体,应采取的物理方法是________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图是硝酸钾的溶解度曲线,回答下列问题:
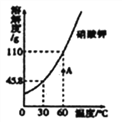
(1)硝酸钾的溶解度随温度升高而______________ ;
(2)当温度为__________℃时,硝酸钾的溶解度为110g;
(3)图中点A所对应的是该温度下硝酸钾的___________(选填“饱和”或“不饱和”)溶液。
-
科目: 来源: 题型:
查看答案和解析>>【题目】水与人类的生活息息相关。
(一)、天然水净化为自来水的主要流程如下:
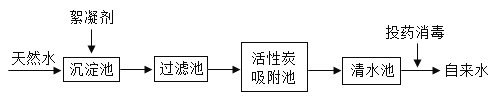
(1)下列说法不正确的是(填字母)________。
A.过滤池可以除去难溶性杂质 B.活性炭吸附池可以除去水中的色素和臭味 C.清水池中一定是软水
(2)明矾(主要成分KAl(SO4)m)能作絮凝剂,是因为明矾溶于水后生成具有吸附作用的胶状物氢氧化铝。m=______
(3)生活中,人们常用__________检验水样品是硬水还是软水。硬水危害人们健康,生活中软化硬水最常用、最简单的方法是____________。
(4)水是生命之源,我国水资源总量虽位居世界第六位,但人均水量很少。请你写出一条节约用水的方法:_____________________。
(二)、下图是实验室电解水原理的装置图
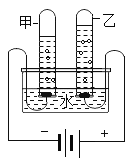
(1)保持水的化学性质的最小微粒是________,图中试管乙中的气体是______(均填名称)。
(2)电解水的化学方程式是_________________________。
(3)实验室用“电解水”或“氢气在氧气中燃烧”的实验探究水的组成元素,理论依据是______。
-
科目: 来源: 题型:
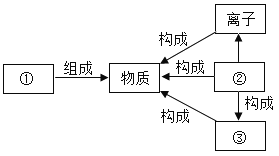
查看答案和解析>>【题目】在宏观、微观和符号之间建立联系是化学科学习的特点。
(1)某同学绘制的知识间联系图如下图所示。其中②是_______(填“分子”、“原子”或“元素”)。
(2)下图所示为某些元素和原子结构的部分信息。
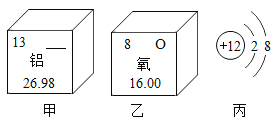
①乙图所示元素的原子的核电荷数是_______。
②丙图所示的粒子属于_______(填“原子”、“阳离子”或“阴离子”。
③其中属于非金属元素的是_________(填甲、乙或丙)。
(3)若用
 表示氧原子,用
表示氧原子,用 表示氢原子.则
表示氢原子.则 表示__,
表示__, 表示__,
表示__, 表示__(填化学符号)
表示__(填化学符号)(4)如下图所示“
 ”和“
”和“ ”表示两种不同的原子.
”表示两种不同的原子.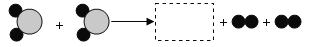
①该反应中反应物_______(填“可能”或“不可能”)是氧化物。
②图中虚线方框内对应的微观图示是_______(选A、B、C、D)。

③该化学反应的基本类型属于________________________。
相关试题

