【题目】(6分)小明在实验室里加热31.6g高锰酸钾制取氧气,完全反应后剩余固体质量为28.4g。将剩余固体溶解、过滤、烘干、称量,回收二氧化锰。请计算:
(1)生成氧气的质量为 g。
(2)回收过程中溶解和过滤均用到玻璃棒,它们的作用分别是 、 。
(3)回收得到二氧化锰的质量。(写出计算过程)
参考答案:
【答案】解:(1)生成氧气的质量=31.6g-28.4g=3.2g;
(2) 搅拌加速溶解、引流 ;
(3)2KMnO4![]() K2MnO4+MnO2+O2↑ (1分)
K2MnO4+MnO2+O2↑ (1分)
87 32
x 3.2g
![]()
X=8.7g
【解析】
试题分析:(1)反应中减少的质量是生成氧气的质量;(2)玻璃棒在溶解时用于搅拌以加速物质的溶解,在过滤时用于引流,使液体沿着玻璃棒进入漏斗中;(3)根据氧气的质量结合化学方程式计算出生成的二氧化锰的质量;
-
科目: 来源: 题型:
查看答案和解析>>【题目】人们习惯上把金、银、铜、铁、锡五种金属统称为“五金”。其中金属活动性最强的是
A.金 B.铜 C.铁 D.锡
-
科目: 来源: 题型:
查看答案和解析>>【题目】为了防止事故发生,下列做法正确的是
A.天然气泄漏时,立即打开排气扇电源开关
B.电器着火时立即用水扑灭
C.室内着火时,打开所有的门窗
D.被围困在火灾区时,用湿毛巾捂住口鼻低下身子逃生
-
科目: 来源: 题型:
查看答案和解析>>【题目】(8分)了解物质的组成和结构,有助于认识物质的性质。
(1)下图表示核电荷数为11-17的元素最高和最低化合价。
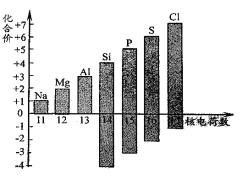
①从图中可以看出,氯元素的最高正价是 。
②若某元素既可显正价,又可显负价,则最高正价与最低负价绝对值的代数和为 。
③写出图中元素的化合价随着核电荷数递增的一条变化规律 。
(2)在3Cu+8HNO3(稀)=3Cu(NO3)2+2X↑+4H2O反应中:
①X的化学式为 ;
②HNO3中氮元素的质量分数为 (保留一位小数);
③Cu(NO3)2中铜元素、氧元素的质量比为 ;
④该反应涉及的物质中,直接由原子构成的是 ;水是由 构成。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列物质属于纯净物的是
A.合金 B.大理石 C.甲烷 D.铁锈
-
科目: 来源: 题型:
查看答案和解析>>【题目】(5分)某兴趣小组同学探究影响双氧水分解速度的某种因素和验证质量守恒定律实验时,数据记录如下:
双氧水的质量
双氧水的浓度
MnO2的质量
相同时间内产生O2体积
Ⅰ
50.0g
1%
0.1g
9 mL
Ⅱ
50.0g
2%
0.1g
16 mL
Ⅲ
50.0g
4%
0.1g
31 mL
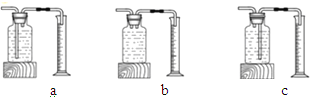
(1)本实验中,测量O2体积的装置是 (填编号)。
(2)实验结论:在相同条件下,双氧水的浓度越 (选填“大”或“小”),双氧水分解得越快。
(3)小王同学用下图装置进行实验,通过比较 也能达到实验目的。
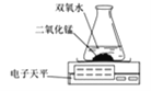
(4)小张同学看到电子天平数据比混合之前数据减小了,他认为该反应不遵守质量守恒定律。你认为他的看
法 (填正确或错误),原因是
-
科目: 来源: 题型:
查看答案和解析>>【题目】科学家成功地利用精密仪器从石墨中分离出单层的石墨片,这是目前世界上人工制得的最薄的材料,下列有关石墨片说法错误的是
A.石墨片是一种单质
B.石墨片与C60是同种物质,具有导电性
C.在一定条件下,石墨片可还原氧化铜
D.石墨片在氧气中完全燃烧的产物是CO2
相关试题

