【题目】往硝酸铜、硝酸银和硝酸亚铁的混合溶液中缓慢连续加入质量为m的锌粉,溶液中析出固体的质量与参加反应的锌粉质量关系如图所示,下列说法中正确的是
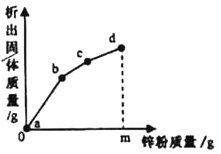
A. bc段(不含两端点)析出的金属是Fe
B. c点对应溶液中含有的金属离子为Zn2+和Cu2+
C. ab段(不含两端点)对应溶液中含有的金属离子为Zn2+、Ag+、Cu2+、Fe2+
D. 若bc段和cd段中析出固体质量相等,参加反应的锌粉质量分别为m1和m2,m1>m2
参考答案:
【答案】C
【解析】A、每65份质量的锌会置换出216份质量的银,会置换出64份质量的铜,会置换出56份质量的铁,依据图象中的斜率可知,ab段是锌与硝酸银的反应,bc段是锌与硝酸铜的反应,cd段是锌与硝酸亚铁的反应, bc段(不含两端点)是锌和硝酸铜的反应,所以析出的金属是Cu,错误;B、c点对应溶液中含有的金属离子为Zn2+和Fe2+,错误;C、ab段(不含两端点)是锌和硝酸银的反应,所以对应溶液中含有的金属离子为Zn2+、Ag+、Cu2+和Fe2+,正确;D、每65质量的锌会置换出64份质量的铜或56份质量的铁,所以若bc段和cd段中析出固体质量相等,参加反应的锌粉质量分别为m1和m2,则m1<m2,错误。故选C。
-
科目: 来源: 题型:
查看答案和解析>>【题目】取10.9g纯碱样品(含少量氯化钠杂质)完全溶于108.8g水中,再向其中逐滴加入100g溶质质量分数为20.8%的氯化钡溶液,恰好完全反应,所得溶液为不饱和溶液,请根据题意回答下列问题:
(1)100g溶质质量分数为20.8%的氯化钡溶液中氯化钡的质量为__g;
(2)完全反应后所得溶液中溶质的质量分数为多少_______? (写出计算过程)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】为了达到相应的实验目的,下列实验设计部不合理的是
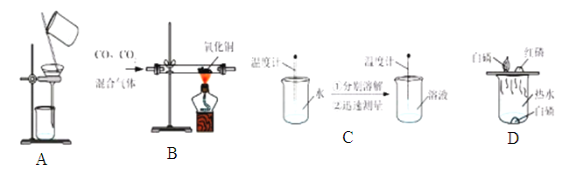
A.分离H2O2和MnO2制O2后的固液混合物 B.除去CO中的CO2气体
C.区分NaCl、NH4NO3、NaOH三种固体 D.探究可燃物燃烧的条件
-
科目: 来源: 题型:
查看答案和解析>>【题目】图一是甲、乙、丙三种固体物质(不含结晶水)的溶解度曲线,图二是30℃时,取其中两种固体各1g分别放进盛有10g水的两只试管中,充分振荡后的溶解情况。下列说法正确的是
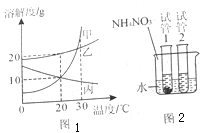
A.甲物质的溶解度比乙物质的溶解度大
B.加入试管1的固体是丙
C.向烧杯中加入硝酸铵固体后,试管2中一定有晶体析出
D.将30℃时甲、乙、丙三种物质的饱和溶液降温到20℃,所得溶液中溶质的质量分数的大小关系是乙>甲=丙
-
科目: 来源: 题型:
查看答案和解析>>【题目】请用化学用语或名称填空:
(l)2NH4+ ___________; (3)2CCl4 ______________________________;
(3)不含电子的离子______; (4)标注出次氯酸(HClO)中氯元素的化合价________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】A~G是初中化学常见的物质,B和D能参与光合作用,F可用于改良酸性土壤. 它们之间的关系如图所示(“﹣”表示相连两物质之间能发生反应,“→”表示由某一物成转化为另一物质,部分反应物、生成物及反应条件已略去),每个虚线圈中各反应的基本反应类型相同.
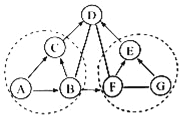
(1)写出物质的化学式:A_______,G__________.
(2)反应F→E的基木反应类型是__________.
(3)反应D﹣F的化学方程式是__________________.
(4)反应G→E的现象是________.
-
科目: 来源: 题型:
查看答案和解析>>【题目】根据题下图所示装置,结合所学知识回答下列问题。
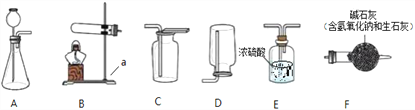
(1)仪器名称a_______;
(2)实验室制取二氧化碳气体的化学方程式为____________________,若要收集干燥的CO2气体,则收集装置为________(选填装置对应的字母)。
(3)实验室常用硫酸吸收氨气,防止污染空气,实验室制备NH3的反应原理为:Ca(OH)2(固)+2NH4Cl(固)
 CaCl2+2H2O+2NH3↑。现要制备并干燥NH3,所选装置的正确连接顺序为________→________(选择装置对应的字母)。
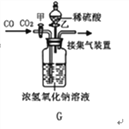
CaCl2+2H2O+2NH3↑。现要制备并干燥NH3,所选装置的正确连接顺序为________→________(选择装置对应的字母)。 (4)工业上常需分离CO、CO2的混合气体。某同学采用装置G也能达到分离该混合气体的目的,操作步骤如下:
① 关闭活塞乙,打开活塞甲,通入混合气体,可收集到_______气体;
② 然后,________________________(填操作),又可收集到另一种气体,写出该步的化学方程式___________________________。
相关试题

