【题目】工业上,通过如下转化可制得KClO3晶体。

(1)KClO3中氯元素的化合价为_______。
(2)生产中所用NaCl溶液由粗盐水精制而成,精制时除去粗盐水中泥沙,采用的操作是_______。
(3)完善Ⅰ中反应的化学方程式:NaCl+3H2O=NaClO3 +3_______
(4)已知NaClO3+KCl=NaCl+KClO3,Ⅱ中析出晶体后的滤液是KClO3的_______(填“饱和溶液”或“不饱和溶液”)。
(5)上述流程中,可循环利用的物质是_______
参考答案:
【答案】 +5 过滤 H2↑ 饱和溶液 NaCl和KCl
【解析】(1)化合物中元素的化合价的代数和为零,设氯元素的化合价为x,则x+(+1)+(-2)×3=0 X=+5;(2). 过滤能将难溶性固体与液体分离,精制时除去粗盐水中泥沙,采用的操作是过滤 (3). 由质量守恒定律可知,反应前后原子的种类个数不变,所以化学方程式为:NaCl+3H2O========NaClO3 +3H2↑ (4). 饱和溶液是在一定温度下、一定量的溶剂里不能再溶解某物质的溶液叫该物质的饱和溶液,反之为不饱和溶液。析出晶体后的滤液是KClO3的饱和溶液 (5). NaCl和KCl是工艺流程中的生成物,同时又是相应的原料,所以可循环使用;
-
科目: 来源: 题型:
查看答案和解析>>【题目】某同学利用下图所示装置进行实验。已知:白磷的着火点是40℃
步骤I.检查装置的气密性。
步骤II.将盛有足量白磷的带孔燃烧匙伸入A瓶中,向瓶中加满80℃热水,塞紧瓶塞。
步骤III.打开K1、K2,从a口向瓶中鼓入空气,待瓶中的液面低于燃烧匙底部时,关闭K1、K2。此时量筒中水的体积为200mL。
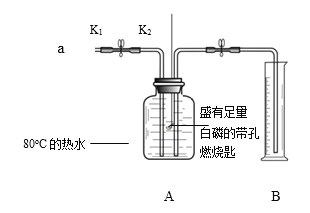
(1)步骤Ⅲ中,关闭K1、K2后观察到的现象是______,反应的化学方程式为______。
(2)对比步骤II和III可知,可燃物燃烧的条件之一是______。
(3)待装置冷却至室温后,打开K2,观察到______,说明空气中氧气的含量约占1/5。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某同学利用以下用品进行二氧化碳性质实验。

【实验1】向图1集满CO2的软塑料瓶中,迅速倒入半瓶蒸馏水,旋紧瓶盖。充分振荡,观察到塑料瓶变瘪,原因是_______。
【实验2】在图2点滴板①②两个孔内各滴加2滴紫色石蕊溶液;再向①孔中滴加5滴实验1塑料瓶中的液体,向②孔中滴加5滴蒸馏水,观察到①孔中紫色石蕊变红,变红的原因是_______(用化学方程式表示)。②孔中滴加等量蒸馏水的目的是_______。
-
科目: 来源: 题型:
查看答案和解析>>【题目】过氧化钠(Na2O2)为淡黄色固体,可用作潜水艇或呼吸面具的供氧剂,工业制备的主要流程如下:
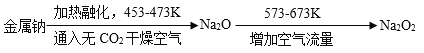
(1)4Na +O2====2Na2O(反应条件略去),该反应属于基本反应类型中的_____反应。
(2)已知过氧化钠(Na2O2)产生氧气(O2)的化学方程式为:2Na2O2 +2CO2====2 Na2CO3+O2,理论上156g过氧化钠可制得氧气质量为____g。
-
科目: 来源: 题型:
查看答案和解析>>【题目】 小强用托盘天平称量5.1 g食盐时,1 g以下用游码,称后发现砝码放在了左盘食盐放在了右盘。所称食盐的实际质量为
A .4.9 g B. 5.1 g C. 5.0 g D. 5.3 g
-
科目: 来源: 题型:
查看答案和解析>>【题目】空气是一种宝贵的自然资源,下列气体不可直接从空气分离获得的是
A. 用作医疗急救的氧气 B. 用作焊接保护气的稀有气体
C. 用作食品防腐剂的氮气 D. 用作清洁燃料的氢气
-
科目: 来源: 题型:
查看答案和解析>>【题目】请从A或B两组趣味实验中任选1个作答,若两题均作答,按A计分。
A
B

(1)向一盛有少量干冰的玻璃容器中加入适量热水,立即产生浓厚的白雾,产生此现象的原因是。____
(2)另取一盛有适量澄清石灰水的玻璃容器,向其中加入少量干冰,观察到澄清石灰水变浑浊,发生反应的化学方程式为______。

(1)点燃蜡烛后,电子秤示数逐渐减小。蜡烛减小的质量____(填“大于”“等于”或“小于”)燃烧后生成物的总质量。
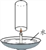
(2)用玻璃杯迅速扣住燃烧的蜡烛,并使杯口始终浸没在水中最终杯中液面____(填“高于”“等于”或“低于”)碗中液面。
相关试题

