【题目】请从A或B两组趣味实验中任选1个作答,若两题均作答,按A计分。
A | B |
(1)向一盛有少量干冰的玻璃容器中加入适量热水,立即产生浓厚的白雾,产生此现象的原因是。____ (2)另取一盛有适量澄清石灰水的玻璃容器,向其中加入少量干冰,观察到澄清石灰水变浑浊,发生反应的化学方程式为______。 |
(1)点燃蜡烛后,电子秤示数逐渐减小。蜡烛减小的质量____(填“大于”“等于”或“小于”)燃烧后生成物的总质量。
(2)用玻璃杯迅速扣住燃烧的蜡烛,并使杯口始终浸没在水中最终杯中液面____(填“高于”“等于”或“低于”)碗中液面。 |
参考答案:
【答案】 干冰升华吸热,使周围的水蒸气冷凝成小水滴 CO2+Ca(OH)2CaCO3↓+H2O 小于 高于
【解析】(1)干冰是固体二氧化碳的俗称,向一盛有少量干冰的玻璃容器中加入适量热水,立即产生浓厚的白雾,产生此现象的原因是干冰升华吸热,使周围的水蒸气冷凝成小水滴,形成白雾;(2). 二氧化碳能与石灰水中的溶质氢氧化钙反应生成碳酸钙沉淀和水,使澄清石灰水变浑浊,反应方程式为:CO2+Ca(OH)2CaCO3↓+H2O,(3)由质量守恒定律可知,参加反应的各物质的质量总和等于反应后生成的各物质的质量总和,所以蜡烛减少的质量与反应的氧气的质量和,等于生成物的总质量,用玻璃杯迅速扣住燃烧的蜡烛,并使杯口始终浸没在水中最终杯中液面高于碗中液面,因为蜡烛燃烧消耗掉杯内的氧气,生成的二氧化碳又溶于水,使杯内气体减少,压强变小,小于外界大气压,在压力差的作用下,碗中的液体进入杯内。
-
科目: 来源: 题型:
查看答案和解析>>【题目】工业上,通过如下转化可制得KClO3晶体。

(1)KClO3中氯元素的化合价为_______。
(2)生产中所用NaCl溶液由粗盐水精制而成,精制时除去粗盐水中泥沙,采用的操作是_______。
(3)完善Ⅰ中反应的化学方程式:NaCl+3H2O=NaClO3 +3_______
(4)已知NaClO3+KCl=NaCl+KClO3,Ⅱ中析出晶体后的滤液是KClO3的_______(填“饱和溶液”或“不饱和溶液”)。
(5)上述流程中,可循环利用的物质是_______
-
科目: 来源: 题型:
查看答案和解析>>【题目】 小强用托盘天平称量5.1 g食盐时,1 g以下用游码,称后发现砝码放在了左盘食盐放在了右盘。所称食盐的实际质量为
A .4.9 g B. 5.1 g C. 5.0 g D. 5.3 g
-
科目: 来源: 题型:
查看答案和解析>>【题目】空气是一种宝贵的自然资源,下列气体不可直接从空气分离获得的是
A. 用作医疗急救的氧气 B. 用作焊接保护气的稀有气体
C. 用作食品防腐剂的氮气 D. 用作清洁燃料的氢气
-
科目: 来源: 题型:
查看答案和解析>>【题目】阅读下面科普短文(原文作者:龙门、宋野等,原文有删改)
咸鸭蛋是人们常用的一种食品,咸鸭蛋黄还是制作粽子、点心等食品的材料。咸鸭蛋中富含锌、钙,对儿童身体及骨骼的生长有帮助,并能在一定程度上预防贫血。
资料1:腌制原理
咸鸭蛋在腌制过程中,食盐通过蛋壳及蛋壳膜不断向蛋内渗透,虽然没有改变蛋白质及脂肪的成分,但却改变了蛋白中蛋白质的特性及蛋黄中脂质含量。
资料2:腌制过程
腌制鸭蛋一般经过以下几个步骤:鲜蛋→检验(照蛋)→洗蛋→晾干→放入食盐水溶液中装罐→腌制。一般腌制30天,就能得到味美的咸鸭蛋。资料显示,将晾干后的鲜鸭蛋放入1%的盐酸溶液中浸泡10分钟,蛋壳(主要成分是CaCO3)与盐酸溶液发生反应,蛋壳表面的毛孔增大。放入饱和的食盐水中,溶液更易通过蛋膜进入蛋清,只需7天左右就可腌制出合格的咸蛋(蛋内的食盐含量及蛋黄内的油脂含量均达到国家标准),且口感很好。
资料3:影响咸鸭蛋品质的因素
咸鸭蛋的蛋黄指数是鸭蛋品质的一个重要指标。一般情况下,蛋黄指数越高,品质越好。不同腌制条件对蛋黄指数的影响如下所示。
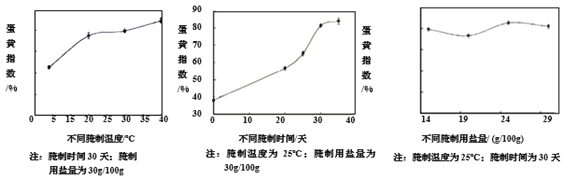
资料4:咸鸭蛋的食用
咸鸭蛋与鲜蛋的营养价值基本相同,但咸鸭蛋中钠、钙、铁、硒等矿物质元素含量比鲜鸭蛋高。特别是含钠量高,折算成含盐量,每只咸蛋含盐在6g以上。长期高盐摄取是造成高血压、胃粘膜受损等疾病的原因。
依据文章内容,回答下列问题。
(1)鲜鸭蛋及咸鸭蛋中均含锌、钙,“锌”“钙”指的是________(填“分子”、“原子”
或“元素”)。
(2)请写出蛋壳和盐酸反应的化学方程式__________。
(3)影响咸鸭蛋品质的因素有_____________。
(4)当腌制温度为25℃、腌制时间为30天时,用盐量为_____g/(100g),咸鸭蛋品质最高。
(5)请写出一条食用咸鸭蛋的建议_____________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】元素周期表中,同周期元素的结构和性质呈现一定的规律性变化。下表列出的是第三周期元素的主要化合价(部分信息未列出)。用相应的化学用语填空。
元素
Na
Mg
①
Si
P
②
Cl
原子的最外层电子数
1
2
3
4
5
6
7
最高正价
最低负价
+1
+2
③
+4
-4
+5
-3
④
+7
-1
(1)②元素的名称是_____________①和②元素形成的化合物的化学式为__________
(2)③处填的化合价为 ______________
(3)④处的最高正价是+6,最低负价是 ______。由此你可以得出有关元素化合价的一条规律为________________。
元素X、Y、Z、M是初中常见的四种元素。有关信息如下表:
元素
有关信息
X
可形成相对分子质量最小的气体单质
Y
空气中含量最多的元素
Z
其单质约占空气总体积的1\5
M
生活中最常见、用量最大的金属元素
①由X、Y两种元素组成的最简单的气体是_________________(填化学式)
②由X、Z两种元素按原子个数比1:1组成的化合物,写出它快速分解反应的化学方程式______________________。
③写出M的单质在氧气中燃烧的化学方程式________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】自然界中无时不在进行着CO2、H2O、O2的循环,使地球充满勃勃生机.
(1)物质的组成 :
从分子、原子及元素的角度看,地球表面的“水循环”主要是由___________的运动引起的,自然界“碳循环”中的“碳”是指___________。
水是重要的氧化物,写出电解水反应的化学方程式:___________________
下列反应中,不能用来确定水由氢、氧元素组成的是 ________。(填序号)
A、H2和O2反应 B、电解水 C、H2和C12反应 D、H2和CuO反应
(2)物质的变化:海洋是一个巨大的资源宝库,可以从海水中提取氯化钠,并以氯化钠和水为原料制得氢氧化钠、氢气和氯气(Cl2)。其主要工艺流程如下:

风吹日晒可以从海水中提取粗盐,该过程主要发生______变化(“物理”或“化学”)。
要除去海水中混有少量的泥沙,你的操作方法是____________。
经过以上操作之后将一定量的海水蒸发一段时间后如图,剩余海水中氯化钠的质量分数会____________(“变大”、“变小”或“不变”),蒸发过程中玻璃棒的作用是___________,
④氯化钠饱和溶液在通电条件下发生反应的化学方程式是:_________________。
(3)辩证地认识物质:绿色植物的光合作用离不开CO2,通过光合作用将太阳能转化为 _______能,CO2的含量应保持相对稳定,如果排放入空气中的CO2 过多,可能会加剧________________。
(4)珍惜资源、节能环保:如图属于“国家节水标志”的是______(填序号)。

相关试题



