【题目】(7分)海洋为我们提供了丰富的资源,二十一世纪是海洋开发与利用的世纪,请围绕“海洋”这个话题回答以下问题:
(1)下图是我们从海水中提取镁的流程图:
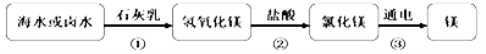
①上述一系列转化过程中,属于中和反应的是 (写化学方程式)
②对于如何在海水制镁过程中沉淀镁离子,甲、乙、丙三位同学各自提出自己的设想,
甲:直接往海水中加入石灰乳
乙:高温加热蒸发海水后,加入石灰乳
丙:向晒盐后的卤水(既母液)中,加入石灰乳。
通过分析比较,你认为 的设想最为经济合理(选填“甲”、“乙”或“丙”)。
(2)关于海水“制碱”中得到的“碱”的成分,甲同学认为是氢氧化钠,乙同学认为是碳酸钠,为确定这个“碱”是氢氧化钠还是碳酸钠,甲、乙同学各做了以下两个实验:
①甲同学向“碱”溶液中加入酚酞,观察到酚酞变红,于是认为“碱”是氢氧化钠。
②乙同学向“碱”溶液中加入硝酸钙溶液,产生白色沉淀,于是认为“碱”是碳酸钠。
你同意 (填“甲”或“乙”)同学的观点,请指出另一个同学实验的不合理之处 。
(3)从海水晒盐留下的“苦卤”中加工得到不纯的硫酸镁晶体,其中含有少量氯化钠,根据下图的溶解度曲线回答下列问题:
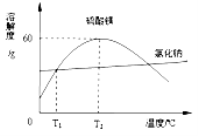
①T1℃时,等质量的水中达到饱和时溶解的硫酸镁质量 (填大于、小于或等于)氯化钠的质量。
②T2℃时,向50g水中加入50g硫酸镁,所得溶液的溶质质量分数是 。
③要除去少量的氯化钠,得到较纯净的硫酸镁,可采用的方法是 (填“A”、“B”或“C”)。
A.过滤
B.蒸干水分
C.将T2℃硫酸镁的饱和溶液升温,析出晶体后过滤
参考答案:
【答案】(1)① Mg(OH)2+2HCl=MgCl2+2H2O ② 丙
(2)乙 碳酸钠溶液呈碱性,也能够使酚酞试液变红(其他合理解释也给分)
(3)① 大于 ② 37.5% ③ C
【解析】
试题分析:(1)①分析图1中的实验流程可以知道,属于中和反应的为氢氧化镁和稀盐酸的反应,该反应生成了氯化镁和水,其化学方程式为:Mg(OH)2+2HCl═MgCl2+2H2O。②三种方式中甲需要大量的石灰乳,乙则需要加热消耗能量,只有丙的方式中由于水分的蒸发,而能够节约原料和能源,所以丙同学的方案最可行。
(2)碳酸钠溶液也呈碱性,可以使酚酞变红,所以不能根据酚酞变红就判定为氢氧化钠,即乙同学的操作正确。
(3)①比较图2中的溶解度曲线可以知道t1℃时,氯化钠和硫酸镁的溶解度相等,所以该温度下等质量的水中最多溶解的硫酸镁质量等于最多溶解的氯化钠的质量。②t2℃时,硫酸镁的溶解度为60g,根据溶解度的定义可以知道,向50克水中加入50克硫酸镁,只能溶解30g,所以所得溶液的溶质质量分数是:30g/(30g+50g)×100%=37.5%。③分析图中曲线可以知道t2℃后,硫酸镁的溶解度随温度升高而降低,而氯化钠的溶解度随温度升高而升高,所以要提纯硫酸镁可以将t2℃硫酸镁的饱和溶液升温,析出晶体后过滤即得较为纯净的硫酸镁,故选C。
-
科目: 来源: 题型:
查看答案和解析>>【题目】鉴别一杯硝酸钾溶液是否是饱和,可采取的最佳方法为
A.加热
B.降温
C.加入硝酸钾
D.加入该温度下的硝酸钾饱和溶液
-
科目: 来源: 题型:
查看答案和解析>>【题目】(4分)能源、环境与人类的生活和社会发展密切相关。
(1)氢气是我们未来社会最理想的能源。氢气作燃料除燃烧时产生较多的热量外,另一个优点是 。
(2)为减少污染、提高焦炭的利用率,可将焦炭转化为可燃性气体。此过程可认为是碳与水的反应,其微观示意图如下图所示:

关于该反应的下列说法中,正确的是 (填序号)。
①反应前后分子的种类没有改变
②反应前后所有元素的化合价都没有变化
③参加反应的A、B两物质的微粒个数比是1:3
④该反应是置换反应
(3)经研究发现NH3在氧气中充分燃烧生成水蒸气和空气中含量最多的气体,产物没有污染,释放大量的热,有一定应用前景。
①NH3中氮元素和氢元素的质量比为 。
②写出NH3在氧气中充分燃烧的化学方程式 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】复合肥能同时提供几种养分,给农作物以“全面呵护”.下列属于复合肥的是( )
A.硫酸钾(K2SO4)
B.磷酸二氢铵(NH4H2PO4)
C.尿素[CO(NH2)2]
D.硝酸铵(NH4NO3)
-
科目: 来源: 题型:
查看答案和解析>>【题目】(7分)某同学为验证质量守恒定律,向烧杯中加入40g溶质质量分数为20%的硫酸铜溶液,另取两只试管,向其中一只试管中加入一定质量的氢氧化钠溶液,向另一只试管中加入足量的稀硫酸。
第一步:如图所示,将试管放入烧杯中并在天平上称重。

第二步:先将氢氧化钠溶液倒入烧杯中,能观察到的反应现象是 ;随后再将足量的稀硫酸倒入烧杯中,能观察到的反应现象是 。
第三步:将两只试管放回烧杯中,并将烧杯重新放在天平的左盘上,能观察到天平指针 (填“偏左”、“偏右”或“保持不变”)。
计算:若使硫酸铜溶液与氢氧化钠溶液恰好完全反应,计算参加反应的氢氧化钠溶液中溶质的质量。
-
科目: 来源: 题型:
查看答案和解析>>【题目】小军同学在做家庭小实验时.向热的大米粥中加入碘酒,发现未变蓝色.面对“异常”现象,他不应该采取的做法是
A.向老师请教
B.查找相关资料,探究原因
C.反复实验.并观察是否有相同现象
D.认为自己做错了,继续做其它实验
-
科目: 来源: 题型:
查看答案和解析>>【题目】植物生长需要养分,土壤所能提供的养分是有限的。化肥对提高农作物产量有重要作用,下列化肥中属于复合肥的是( )
A.NH4HCO3 B.K2SO4 C.KNO3 D.Ca3(PO4)2
相关试题

