【题目】人类文明进步与金属材料的发展关系十分密切,金属在生活生产中有着非常广泛的应用。请回答下列问题:
(一)金属的广泛应用
(1)“共享单车”是指在公共场所提供共享服务的自行车,符合“低碳出行”理念,颇受年轻人的喜爱。车上的钢丝网篓属于_____混合(填“纯净物”或“混合物”);
(2)2017年5月5日我国首架试飞成功的大型客机C919使用了多种新材料,其中有锂铝合金,在飞机制造中使用该材料说明其具有的特点有____(填序号)。
①硬度大 ②密度小 ③易导电 ④耐腐蚀
(3)如图为生活中常见“暖贴”的部分标签。暖贴可以贴于身体的某个部位,自行发热,用于取
暖或热敷。使用时空气进入暖贴,空气中的氧气、水蒸气与暖贴中的____铁发生反应而使暖贴放热。使用后,发现暖贴内有物质变为红色,该红色固体主要成分的化学式为_____。

(二)设计对比实验探究铁的化学性质
如图实验是大小形状相同的Mg、Zn、Fe、Cu四种金属同时投入到盐酸中发生的现象,金属周围的黑点表示生成的气体。下列结论不正确的是____。(填字母 )

A.铜不能发生置换反应
B.四种金属中金属活动性位于第三的是Fe
C.等质量的锌和铁分别与足量的盐酸反应生成气体质量:Fe比Zn少
(三)炼铁过程的探究
在化学实验室里,可以利用如图装置制得铁:

(1)A处玻璃管内所发生反应的化学方程式是______,该反应中的还原剂是_____。
(2)装置B中的实验现象是通CO2____________。
(3)C处酒精灯的作用是____________。
(四)定量计算
某化工厂产生的废液中含有硫酸亚铁和硫酸铜(不考虑其它物质 ),为回收铜和硫酸亚铁,研究人员设计出“用铁处理”的方案。取100g上述废液,向其中加入2.8 g铁粉,恰好完全反应,测得反应后溶液中溶质的质量分数为15%。求:
(1)回收得到铜的质量为________g。
(2)回收得到硫酸亚铁的质量是________。(写出计算过程,结果保留小数点后一位)
参考答案:
【答案】混合物 ①②④(少或错不得分) 铁粉 Fe2O3 AC(少或错不得分) Fe2O3+3CO![]() 2Fe+3CO2 CO 澄清的石灰水变浑浊 尾气处理 3.2 14.9g
2Fe+3CO2 CO 澄清的石灰水变浑浊 尾气处理 3.2 14.9g
【解析】
(一)(1)钢是铁的合金,属于混合物;
(2)锂铝合金具有硬度大、密度小和耐腐蚀的性质;
(3)暖贴中的铁粉能与水和氧气反应放热,生成的铁锈的主要成分是氧化铁,化学式为: Fe2O3;
(二)A、铜不能发生酸发生反应,铜可以将硝酸银中的银置换出来,所以不能说铜不会发生置换反应,故错误;
B、镁表面的气泡产生最剧烈,锌次之,铜表面没有气泡产生,所以四种金属中金属活动性位于第三的是Fe,故正确;
C、每65份质量的锌会生成2份质量的氢气,每56份质量的铁会生成2份质量的氢气,所以等质量的锌和铁分别与足量的盐酸发生生成气体质量:Zn比Fe少,故错误;
(三)(1)A中一氧化碳还原氧化铁生成铁和二氧化碳,反应的化学方程式是Fe2O3+3CO![]() 2Fe+3CO2;该反应中CO得到氧,属于还原剂;
2Fe+3CO2;该反应中CO得到氧,属于还原剂;
(2)一氧化碳还原氧化铁生成铁和二氧化碳,试管处观察到的现象是澄清石灰水变浑浊;
(3)一氧化碳具有可燃性,一氧化碳有毒,所以末尾酒精灯的作用是:除去一氧化碳,防止污染环境,进行尾气处理;
(四)(1)设2.8g铁完全反应生成的铜的质量为x,
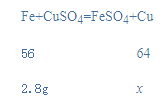
![]()
x=3.2g;
(2)硫酸亚铁质量为(100g+2.8g-3.2g)×15%=14.94g。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某化学兴趣小组利用下列装置进行气体制取的实验。请回答:
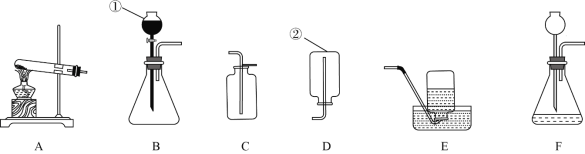
(1)写出标出数字的仪器名称:①________,②________。
(2)用加热高锰酸钾的方法制收并收集干燥的氧气,应该选用的发生及收集装置是________(填装置序号),反应的化学式表达式为________,检验氧气的方法为________________。
(3)氢气是一种无色、无味、密度比空气小且不与空气反应、难溶于水且不与水反应的气体。
①该兴趣小组的同学用干电池的锌皮和白醋混合来制取氢气,他们应选择的发生装置是________(填装置序号,下同),收集装置是________。
②科学家通过研究发现,在一定条件下,可用氢气和氮气做原料制得氨气,请写出这个反应的化学式表达式________,氨气中氮元素的化合价为________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图是证实植物进行光合作用的实验装置,取一个大烧杯,装入大半杯水,烧杯内放入一些金鱼藻,并通入一定量的气体A.静置一段时间后,用漏斗罩住金鱼藻,然后将盛满水的试管倒置于漏斗上。在阳光下放置一段时间,试管内有许多气泡产生,管内液面下降。根据这一实验,回答下列问题。

(1)写出实验室制取气体A的反应的化学式表达式________________;
(2)实验室常用________来检验气体A,有关反应的化学式表达式为________。
(3)通入气体A的目的是________________。
(4)随着反应的进行试管内气体压强会________(填“越来越大”或“越来越小”);试管内液面如图所示时,试管内的气体压强________(填“大于”、“小于”或“等于”)外界大气压强。
-
科目: 来源: 题型:
查看答案和解析>>【题目】小李同学设计下表所示实验,探究金属铜对H2O2分解速率的影响.
操作
装置
现象
(1)取一个铜丝网,卷成筒形,固定在铁丝上.

(2)分别向①和②中注入15mL、30%的H2O2溶液,并放入盛有热水的③中。
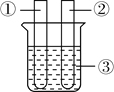
约1min后可观察到①和②中都有少量气泡产生。
(3)把铜丝网(连同固定的铁丝)插入①中。
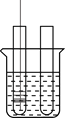
①中有大量气泡产生,5min后不再有气泡产生;此时②中仍然不断有少量气泡产生。
回答下列问题:
(1)仪器②中实验的目的是________。
(2)能否得出铜可以加快H2O2分解速率的结论________(填“是”或“否”)。
(3)如果用上述实验探究铜是不是H2O2分解的催化剂,需要对上述实验方案进行补充,其中必要的是________。
A.称量实验前铜丝网的质量和实验后干燥铜丝网的质量
B.向仪器②中加入二氧化锰
C.将实验后的铜丝网进行加热
D.将铁丝换成铜丝
E.将过氧化氢溶液加水稀释
(4)实验后确定铜可以加快H2O2分解的速率,请写出该反应的化学式表达式_______________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】今年暑假,巴厘岛蓝色可乐汽水风靡全国。下图是该可乐汽水配料表的部分内容,请完成下列问题。
蓝色百事可乐汽水
(配料)碳酸水、白砂糖、磷酸、柠檬酸、柠檬酸钠、食用香精、咖啡因、苯甲酸钠、阿拉伯胶、亮蓝、诱惑红
(净含量)450mL
(营养成分表)
项目
每100毫升
能量
190千焦
蛋白质
0克
脂肪
0克
碳水化合物
11.5克
钠
8毫克
蓝色百事可乐汽水
(配料)碳酸水、白砂糖、磷酸、柠檬酸、柠檬酸钠、食用香精、咖啡因、苯甲酸钠、阿拉伯胶、亮蓝、诱惑红
(净含量)450mL
(营养成分表)
项目
每100毫升
能量
190千焦
蛋白质
0克
脂肪
0克
碳水化合物
11.5克
钠
8毫克
(1)据分析,碳酸水是由二氧化碳溶于水形成的,请写出此反应的化学式表达式_________。
(2)该瓶可乐中含有钠元素________g(精确到0.001g)。
(3)配料表中的苯甲酸钠起防腐作用,其化学式为C7H5O2Na,试计算:
①Mr(C7H5O2Na)=________。
②苯甲酸钠中碳元素、氧元素的质量比为________。
③14.4g苯甲酸钠中含有多少克钠元素________?
-
科目: 来源: 题型:
查看答案和解析>>【题目】采用适当的试剂,可从石灰石 (主要成分是CaCO3 )中获得高纯度CaCO3,其流程如下:(流程中的杂质不溶于水也不与酸反应 )
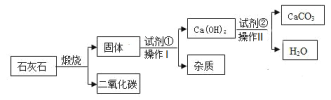
(1)流程图中进行的操作I的名称是____,该操作的温度要求控制在相对____(填“较高”或“较低” )的环境下进行,才能更好地提高提纯效率。
(2)石灰石煅烧反应的基本反应类型是_______。
(3)该流程图所示物质中,溶于水放出大量热的氧化物是_____(填“化学式” )。
(4)使原料中各原子的利用率尽可能达到 100%是“绿色化学”的核心理念之一。上述流程中有的物质可以再利用,该流程中可再利用的物质是 ___和____(填“化学式”)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】化学用语是学习化学的主要工具,是国际通用的化学语言。请你用适当化学用语填空。
(1)保持水化学性质的最小粒子____________;
(2)2个硫酸根离子 _______;(3)标出氧化镁中镁元素的化合价__________;
(4)2个亚铁离子____________(5)氖气___; 两个氢氧根离子_______;氯化钠中的阴离子______;4个二氧化硫分子 ____
相关试题

