【题目】按下列方法配制的溶液,其溶质质量分数为5%的是
A.称取5.0g氯化钾,溶解在95mL水中,充分搅拌
B.称取5.0g生石灰,放入95mL水中,充分搅拌
C.量取5.OmL浓盐酸,倒入95mL水中,充分搅拌
D.称取5.0g二氧化锰,放入95mL水中,充分搅拌
参考答案:
【答案】A
【解析】被溶解的物质叫溶质。溶液的质量等于溶质和溶剂的质量和。![]() 。A.称取5.0g氯化钾,溶解在95mL水中,充分搅拌。固体全溶,溶质为5g,溶液的质量为100g,溶质质量分数为5%。B.称取5.0g生石灰,氧化钙和水反应生成氢氧化钙,溶质为氢氧化钙,但是氢氧化钙是微溶物质,常温下溶解度约0.18g,放入95mL水中,充分搅拌,所得溶液溶质质量分数小于5%;C.量取5.OmL浓盐酸,倒入95mL水中,充分搅拌,浓盐酸中溶质氯化氢只占约37%,且盐酸易挥发,所得溶液溶质质量分数小于5%;D.二氧化锰,不溶于水,得到的是浊液。选A
。A.称取5.0g氯化钾,溶解在95mL水中,充分搅拌。固体全溶,溶质为5g,溶液的质量为100g,溶质质量分数为5%。B.称取5.0g生石灰,氧化钙和水反应生成氢氧化钙,溶质为氢氧化钙,但是氢氧化钙是微溶物质,常温下溶解度约0.18g,放入95mL水中,充分搅拌,所得溶液溶质质量分数小于5%;C.量取5.OmL浓盐酸,倒入95mL水中,充分搅拌,浓盐酸中溶质氯化氢只占约37%,且盐酸易挥发,所得溶液溶质质量分数小于5%;D.二氧化锰,不溶于水,得到的是浊液。选A
-
科目: 来源: 题型:
查看答案和解析>>【题目】为了解甲酸的分解产物,实验小组进行了以下探究:
【查阅资料】甲酸(HCOOH)的熔点为8.6℃,能分解生成两种物质。
【提出猜想】实验小组对甲酸的分解产物提出了猜想:
猜想1.H2和CO2;猜想2.CO和H2O。
【设计实验】20℃时,甲酸的状态为______;从图一装置中选择合适的装置______(填序号)对甲酸进行加热。为了加快分解速率,实验小组加入了催化剂,反应后将分解产物通入图二装置进行实验。
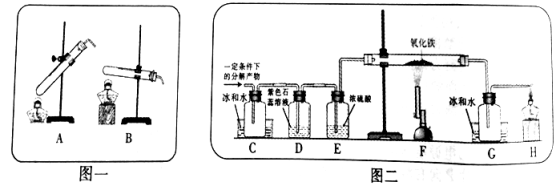
【实验预测】若猜想l成立,则D中的实验现象应为______。
【进行实验】实验中观察到C处瓶内出现大量水珠,F处玻璃管中出现的现象为______,甲酸分解的化学方程式为______。
【交流拓展】资料表明,不同条件下,甲酸的分解产物不同,猜想1和猜想2均能成立。据此小新对甲酸的分解产物又提出新猜想:猜想3.H2O和CO2;猜想4.CO和H2。经讨论认为无需进行实验就能确定猜想3和猜想4都错误,理由是______。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列关于分子和原子的说法错误的是( )
A.“墙内开花墙外香”说明分子是不断运动的
B.“热胀冷缩”说明分子的体积随温度的变化而变化
C.在化学变化中,分子可以再分,原子不可分
D.在原子中,原子数一定等于核外电子数,但不一定等于中子数
-
科目: 来源: 题型:
查看答案和解析>>【题目】学习小组测定某工业废水(含有H2SO4、HNO3,不含固体杂质)中H2SO4的含量。取100g废水于烧杯中,加入100gBaCl2溶液,恰好完全反应,经过滤得到176.7g溶液。
(可溶性杂质不参加反应,过滤后滤液的损失忽略不计)
(1)充分反应后生成沉淀的质量为_______g;
(2)该工业度水中硫酸的质量分数为多少?(写出计算过程)
(3)为避免工业废水污染环境,排放前应对废水进行中和处理,需加入的物质是________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】化学与人体健康关系密切,下列做法或说法不合理的是
A.食用加碘盐有助于预防甲状腺肿大
B.常食蔬菜和水果有助于补充维生素
C.用甲醛溶液浸泡海产品,以延长保鲜时间
D.老年人适量饮食奶制品,可以预防骨质疏松症
-
科目: 来源: 题型:
查看答案和解析>>【题目】人类制得并利用金属有着悠久的历史:
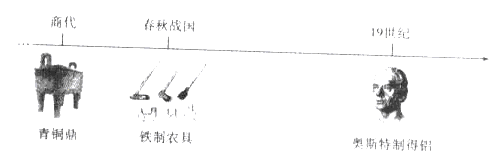
(1)利用孔雀石冶炼铜的主要反应:①Cu2(OH)2CO3
 2CuO+H2O+CO2↑,该反应的类型是_____反应(填“化合”、”分解”或“置换”);
2CuO+H2O+CO2↑,该反应的类型是_____反应(填“化合”、”分解”或“置换”);② 2CuO+C
 2Cu+CO2↑,该反应前后铜元素化合价发生的变化是_。
2Cu+CO2↑,该反应前后铜元素化合价发生的变化是_。( 2 )高炉炼铁的主要反应过程如下.请写出对应的化学方程式:
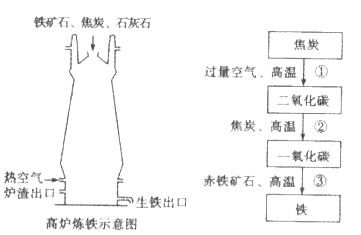
①_________;②_________;③_________。
(3)冶炼金属铝的主要反应:2Al2O3
 4Al+3O2↑,该反应的条件是______。下图的装置中,两种金属的活动性:Zn______ Cu (填“>”或“<”)。当电流表指针发生偏转时,化学能转化为______。
4Al+3O2↑,该反应的条件是______。下图的装置中,两种金属的活动性:Zn______ Cu (填“>”或“<”)。当电流表指针发生偏转时,化学能转化为______。
-
科目: 来源: 题型:
查看答案和解析>>【题目】研究物质的化学反应,可以揭示物质之间转化的规律。
反应一:水在通电条件下生成氢气和氧气
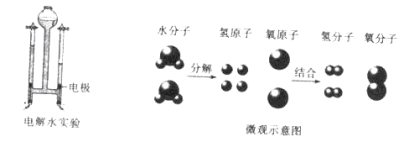
请写出电解水的化学方程式:____________。
反应二:氢气在空气中燃烧生成水
(1)根据所给信息,请画出氢气在氧气中燃烧生成水的微观示意图。
(2)该反应的文字表达式:___________。
(3)该反应的化学方程式:2H2+O2
 2H2O,其表示的含义:
2H2O,其表示的含义:表示1: ___________;
表示2: ___________;
表示3: ___________。
相关试题

