【题目】兴趣小组的同学学习了金属的性质后,在实验室找到的一种银白色金属R做如下探究:
(1)将金属R投入稀盐酸中,金属表面有气泡冒出。则该金属R在金属活动性顺序表中排在氢的___(选填“前面”或“后面”)。
(2)为了比较金属R与铁的活动性强弱,兴趣小组设计下列方案实验,请完成下表:
你的一种猜想 | 验证方法 | 现象 | 结论 |
金属R的活动性比铁______ | 将金属R投入_________ 溶液中 | 金属R表面有黑色的物质析出 | 猜想_______(选填“正确”或“错误”) |
(3)请根据上述的信息,标出金属Fe、R、Cu在下列金属活动性顺序表中的相应位置。
 ____
____
参考答案:
【答案】 前面 强 FeSO4溶液 正确 R >Fe > Cu
【解析】(1)、根据遇酸放出氢气说明金属的活动性排在顺序表中H之前进行解答;(2)、根据有黑色的物质析出,即R可以置换出铁进行解答;(3)、根据上述的实验探究(R的活动性比Fe强)结合金属活动性(Fe的活动性比Cu强)进行解答。解:(1)、遇酸放出氢气说明金属的活动性排在顺序表中H之前;(2)、将R投入到硫酸亚铁溶液中,金属R表面有黑色的物质析出可知,金属R的活动性比铁强;(3)、实验探究(R的活动性比Fe强)结合金属活动性(Fe的活动性比Cu强)可知,可得出:R…Fe…Cu,所以Fe、R、Cu在下列金属活动性顺序表中的相应位置为:R >Fe > Cu (即 )。
)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图为实验室制取气体装置图,请根据要求回答问题
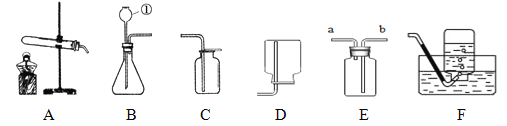
(1) 写出用A发生装置制取气体的应满足的条件________________;
(2) 若选择B、F组合一套装置制取氧气,有关的化学方程式为 ________________ ,装入药品前应先 ___________。反应结束后,若要过滤分离出二氧化锰,可采取的操作是_______ ,该操作过程中速度太慢的原因________________ ;
(3) 若用E装置进行排空气法收集二氧化碳,二氧化碳从E装置的 _________(填a或b)进入,若用E装置进行排水法收集氧气,请简述操作步骤 ______________
(4)实验室要用氯酸钾和二氧化锰制取4.8克氧气,请你用化学方程式计算需氯酸钾的质量为__________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】请用化学方程式表示有关的反应的原理。
(1)实验室制取二氧化碳的原理 _______________
(2)氢气作燃料的原理_______________
(3)氢化钙(CaH2)固体是登山运动员常用的能源提供剂,用它和水反应生成氢氧化钙和氢气。_______________
-
科目: 来源: 题型:
查看答案和解析>>【题目】地沟油中含有一种强烈致癌物黄曲霉素B2(C17H14O6),长期食用会引起消化道癌变,请回答:
(1)黄曲霉素B2的相对分子质量为 ;
(2)黄曲霉素B2中碳、氢、氧三种元素的原子个数比为 ;
(3)15.7g黄曲霉素B2中含有 g氧元素.
-
科目: 来源: 题型:
查看答案和解析>>【题目】根据下列装置回答下列问题:
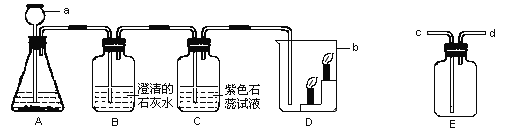
(1)仪器名称:a_______________b_______。
(2)若实验室制取二氧化碳时,长颈漏斗中加入的药品是_____ ,锥形瓶中加入的药品是__________。
(3)装置A中发生的化学方程式为____________,装置C中观察到的现象是___________。
(4)装置D中观察到的现象是___________,说明二氧化碳______________,______________。由此可知,二氧化碳在生活中可用于 ____________ 。
(5)实验室用装置E来收集二氧化碳时,二氧化碳应从 ____(填“c端”或“d端”)通入。
(6)用A装置还可制取________气体,反应的方程式为______________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】课外活动小组为了测定石灰石的纯度,取25g石灰石放入85g稀盐酸的烧杯中,待石灰石完全反应后(杂质不与盐酸反应),烧杯中混合物的质量为101.2 g。求:
(1)生成二氧化碳的质量。
(2)该石灰石中碳酸钙的质量分数。
-
科目: 来源: 题型:
查看答案和解析>>【题目】水是生命之源、万物之基,是人类宝贵的自然资源,我们每个人都要关心水、爱护水、节约用水。
(1)我国规定生活饮用水的水质必须达到下述四项指标:a.不得呈现异色 b.不得有异味 c.应澄清透明 d.不得含有细菌和病毒。其中“c指标”可以通过________ 操作达到。
(2)下列为净化水的操作,其中净化程度最高的是_______。
A. 吸附 B. 蒸馏 C. 过滤 D.静置沉淀
(3)世博园直饮水主要生产流程为:自来水→活性炭→超滤膜分离→紫外线消毒→直饮水,其中活性炭起_______作用。
(4)生活中可以采用____________区分硬水和软水,如果水的硬度大或者病原微生物过多,都可以采取________的方法来降低水的硬度和杀灭病原微生物。
(5)自来水中含有少量Ca(HCO3)2等可溶性化合物,烧水时Ca(HCO3)2发生分解反应,生成难溶性的碳酸钙、水和二氧化碳,这就是壶中出现水垢的原因之一。请写出Ca(HCO3)2受热分解的化学方程式:________________。
相关试题

