【题目】请结合下图回答问题:
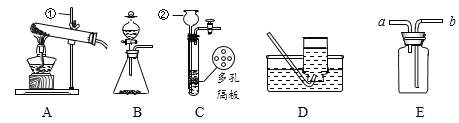
(1)仪器名称:①_____________ ②_____________
(2)用氯酸钾和二氧化锰制取氧气,可选用装置_______(选填序号)和D组合,该反应的化学反应方程式为: _______,此反应中二氧化锰的作用是______。收集好气体时用玻璃片的_____(填“光滑面”或“磨砂面”)盖好集气瓶正放在桌上。
(3)实验室制取CO2,反应的化学反应方程式为: ____,选择装置C的优点是________,可以用____(选填“铜”或“铝”)丝网代替多孔隔板。不能选另一种金属,其原理可用化学方程式表示为:___________;如用E装置收集二氧化碳,气体应从______(填“a”或“b”)进入,验满的方法是_______。
参考答案:
【答案】铁架台 长颈漏斗 A 2KClO3![]() 2KCl+3O2↑ 催化 磨砂面 CaCO3+2HCl=CaCl2+H2O+CO2↑ 便于控制反应的发生和停止 铜 2Al+6HCl=2AlCl3+3H2↑ b 用燃着的木条放在a管口,观察木条是否熄灭,若熄灭则收集满,反之则未满
2KCl+3O2↑ 催化 磨砂面 CaCO3+2HCl=CaCl2+H2O+CO2↑ 便于控制反应的发生和停止 铜 2Al+6HCl=2AlCl3+3H2↑ b 用燃着的木条放在a管口,观察木条是否熄灭,若熄灭则收集满,反之则未满
【解析】
实验室制取氧气、二氧化碳和氢气的反应中,实验药品、反应条件、反应原理、发生装置、收集装置是重点。
(1)①是铁架台,②是长颈漏斗,故填铁架台、长颈漏斗;
(2)氯酸钾是固体,反应需要加热,故填A;氯酸钾在二氧化锰的催化和加热条件下快速生成氯化钾和氧气,故填2KClO3![]() 2KCl+3O2↑;在此反应中二氧化锰做催化剂使用,加快氯酸钾分解的速率,故填催化;集气瓶口是磨砂的,用毛玻片磨砂的一面和集气瓶口形成密封,而光滑的一面不易形成密封,故填磨砂面;
2KCl+3O2↑;在此反应中二氧化锰做催化剂使用,加快氯酸钾分解的速率,故填催化;集气瓶口是磨砂的,用毛玻片磨砂的一面和集气瓶口形成密封,而光滑的一面不易形成密封,故填磨砂面;
(3)实验室用块状药品石灰石或大理石和稀盐酸反应制取二氧化碳,且不需要加热,方程式故填CaCO3+2HCl=CaCl2+H2O+CO2↑;装置C利用多孔隔板,控制反应的发生和停止,开始试验时打开止水夹,长颈漏斗中的液面下降,试管中液面上升,使固体和液体接触发生反应,停止实验时关闭止水夹,试管中液面下降,液体和固体分离反应停止,故填便于控制反应的发生和停止;铜排在金属活动性顺序H的后面,化学性质不活泼,和稀盐酸不反应,可以用来代替塑料隔板,而铝在金属活动性顺序表中排在H前面,化学性质活泼,和稀盐酸能发生置换反应,生成氢气,故填铜,方程式故填2Al+6HCl=2AlCl3+3H2↑;相同条件下二氧化碳气体密度比空气大,可采用向上排空气法,故填b;二氧化碳不可燃也不助燃,验满时是将燃着的木条放在集气瓶口(本题是万用瓶,放在导管口)观察木条是否熄灭,故填用燃着的木条放在a管口,观察木条是否熄灭,若熄灭则收集满,反之则未满。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列图象中有关量的变化趋势与对应叙述关系正确的是( )
A
 B
B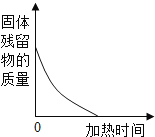 C
C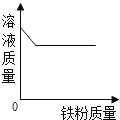 D
D
A. 用等质量氯酸钾分别制取氧气
B. 加热试管中一定质量的高锰酸钾
C. 向一定质量硫酸铜溶液中加铁粉至过量
D. 质量相同且过量的锌和铁与等质量等浓度的稀盐酸反应
-
科目: 来源: 题型:
查看答案和解析>>【题目】用数字和符号表示:
(1)n个碳酸根离子______;(2)人体中含量最多的金属元素是_______;
(3)3个氨气分子________;(4)硫酸亚铁中铁元素的化合价________;
(5)保持氮气化学性质的微粒_____________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】化学与生活息息相关。
(1)茶杯内的纱网可将茶叶与茶水分离,便于饮用。该方法利用的化学原理是____。
(2)自制净水器常加入_____,用于除去水中的异味和色素。
(3)漂白粉可用于自来水的杀菌、消毒,它的有效成分是次氯酸钙[Ca(ClO)2],次氯酸钙可发生如下反应:Ca(ClO)2+ X + H2O= CaCO3↓+ 2 HClO,则x的化学式为___,HClO中Cl的化合价为_______。
-
科目: 来源: 题型:
查看答案和解析>>【题目】A、B、C、D、E、F、G是初中化学常见的物质,A是赤铁矿的主要成分,B、D组成元素相同的气体,E是相同条件下最轻的气体。 反应④为自然界中最普遍的反应。部分反应物、生成物、反应条件已略去。回答问题
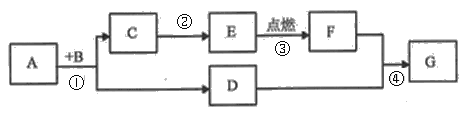
(1)写出C的化学式____________;若G为气体,其名称为:_______________;固体D俗称______。写出E的一种用途_____________ 。
(2)反应①的化学方程式为:_______,该反应中,固体变成_______色;反应②属于______反应(填基本反应类型)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】金属材料广泛应用于生产生活中。
(l)铝块能制成铝箔是利用了铝的_________性(填“导电”或“延展”);铝的“自我保护”原因是___________。(用化学方程式表示)
(2)小张利用图示装置进行甲、乙对比实验,探究温度对CO和Fe2O3反应的影响(固定装置略)
查阅资料:Fe3O4在常温下能与稀盐酸反应,方程式为:Fe3O4+8HCl=2FeCl3+FeCl2+4H2O,不与CuSO4溶液反应。
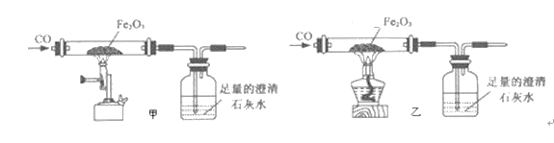
A.实验开始时应先通CO,目的是:___________;
B.从环保角度考虑,图示装置还应采取的改进措施是__________。
C.两实验过程中,澄清石灰水均变浑浊,发生的化学反应方程式为:_________,完全反应后,两组的生成物均为黑色粉末(纯净物),分别用两组生成物进行以下实验:
步骤
操作
甲组现象
乙组现象
1
取黑色粉末,用磁铁吸引
能被吸引
能被吸引
2
取黑色粉末,加入稀盐酸
全部溶解,有大量气泡
无气泡产生
3
取黑色粉末,加入足量CuSO4溶液
有红色物质产生
无明显现象
①甲组的黑色粉末与稀盐酸反应的化学方程式是_________。
②根据实验现象,乙组实验玻璃管中发生的反应方程式为:__________。
③甲、乙两组实验说明温度对CO和Fe2O3反应____________(填有、无或不确定)影响。
(3)小兰对黄铜(Cu – Zn合金)中的Zn的含量进行了探究,将4.0g黄铜粉末放到盛有10g稀硫酸的烧杯中,恰好完全反应,测得烧杯中剩余物质的质量为13.96g, 则:
①生成氢气的质量是_________g;
②若不考虑该合金中除Cu、Zn以外的其他成分,请计算原Cu – Zn合金中Zn的质量分数_______。(计算结果精确到小数点后一位)
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列属于化合反应的是
A. C+2CuO
 2Cu+CO2↑ B. 2CO+O2
2Cu+CO2↑ B. 2CO+O2 2CO2
2CO2C. Ba(OH)2+2HCl=BaCl2+2H2O D. 2KMnO4
 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
相关试题

