【题目】实验室用如图装置进行碳酸钠的性质实验,烧杯A中是澄清石灰水并滴加了酚酞,C中是石灰乳.实验开始前,称取10.6g纯碱置于B中,关闭开关K1打开K2,并加入一定量的稀硫酸.
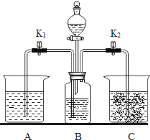
①烧杯C中并没有明显现象,为了证明B中的确产生了CO2,现将C中液体进行固液分离,该分离操作除烧杯外,还需用到的玻璃仪器有_____ (写名称).过滤后滤液能使酚酞试液变红,则滤液中的主要溶质是_____,该现象_________ (填写“能”或“不能”)说明产生了CO2.
②上述过滤后的滤渣可能存在Ca(OH)2和CaCO3.某同学为证明该两种物质同时存在,在一支试管中取少量样品,经过两个步骤完成了检验.若所有检验实验均在该支试管中进行,请完成实验报告:
实验步骤 | 所用的试剂或检验方法 | 结 论 |
步骤一 | _________ | 证明______存在 |
步骤二 | _________ | 证明_______存在 |
③实验一段时间后,关闭开关K2打开K1,见到B中液体将会压入到烧杯A中,实验中可能见到不同的现象,请完成下表:
预测的反应现象 | B中反应后,溶液中溶质的化学式 | 烧杯A中发生的主要反应的化学方程式 |
A中溶液产生大量的白色沉淀产生,红色不褪去. | _________ | _______________ |
A中溶液并没有大量的白色沉淀产生,红色褪去. | _____________ | ________________ |
参考答案:
【答案】漏斗、玻璃棒 Ca(OH)2 不能 取样加水溶解并滴加酚酞,溶液变红色 Ca(OH)2 继续滴加盐酸,有气泡产生 CaCO3 Na2CO3、Na2SO4 Na2CO3+Ca(OH)2= CaCO3↓+2NaOH H2SO4、 Na2SO4 H2SO4+Ca(OH)2= CaSO4+2H2O
【解析】
①通过过滤可将固体与液体分离,过滤操作中用到的玻璃仪器有烧杯、玻璃棒、漏斗。过滤后滤液能使酚酞试液变红,说明滤液显碱性,则滤液中的主要溶质是Ca(OH)2,该现象不能说明产生了CO2.
②步骤一:取样加适量的水溶解并滴加酚酞试液,溶液变红色,说明样品中含有氢氧化钙;步骤二:继续滴加足量盐酸,有气泡产生,说明样品中含有碳酸钙。
③A中溶液产生大量的白色沉淀产生,红色不褪去,说明B中反应后的溶质中含有碳酸钠和硫酸钠,即硫酸和碳酸钠反应时碳酸钠过量,碳酸钠和氢氧化钙反应生成白色沉淀碳酸钙和氢氧化钠。烧杯A中发生反应的化学方程式为:Na2CO3+Ca(OH)2= CaCO3↓+2NaOH。A中溶液并没有大量的白色沉淀产生,红色褪去,说明B中反应后溶液中的溶质是硫酸和硫酸钠,即硫酸和硫酸钠反应时硫酸过量,烧杯A中发生反应的化学方程式为:H2SO4+Ca(OH)2= CaSO4+2H2O。
-
科目: 来源: 题型:
查看答案和解析>>【题目】为测定石灰石样品中碳酸钙的质量分数,某学习小组进行了如下实验探究,取10g石灰石样品放入烧杯中,加入稀盐酸至不再产生气泡为止(石灰石中的杂质不溶于水,也不反应),并绘制了加入稀盐酸的质量与放出气体质量的坐标图(见图).
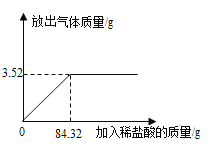
(1)碳酸钙完全反应用去稀盐酸的质量为 g.
(2)该石灰石样品中碳酸钙的质量分数为 .
(3)当盐酸和石灰石恰好完全反应,所得溶液中溶质质量分数是多少?(规范写出计算过程)
-
科目: 来源: 题型:
查看答案和解析>>【题目】A~H 是初中化学常见的8 种物质,分别由C、 H、O、Cl、Ca中的一种或几种元素组成,已知A、B、C、D是不同类别的物质,C是大理石的主要成分,D、G组成元素相同,E是一种可燃性气体,H常温下是一种气态单质。这些物质之间相互关系如右图所示,图中“—”表示能相互反应,图中“→”表示转化关系。(部分反应物、生成物及反应条件已略去)
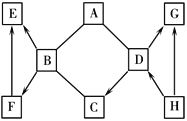
(1)C的化学式是______。
(2)A与B反应的化学方程式是__________。F→E反应的化学方程式是_________。
(3)D→G反应的基本反应类型是_______。
(4)H的一种用途是__________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】从海水得到的粗盐,往往含有可溶性杂质(主要有CaCl2、MgCl2、Na2SO4)和不溶性杂质(泥沙等),必须进行分离和提纯后才能用于工业生产和人们的日常生活.粗盐提纯的部分流程如图:
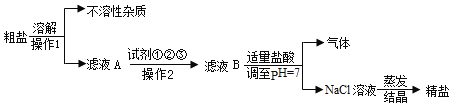
其中,滤液A至滤液B之间需加入的三种试剂为:
试剂①:加入过量的X,除去滤液中的Ca2+
试剂②:加入过量的NaOH,除去滤液中的Mg2+
试剂③:加入过量的BaCl2,除去滤液中的SO42﹣
请回答:
(1)试剂①中的物质X的化学式为____,为最终获得精盐,加入试剂①、②和③后进行的实验正确的操作2的名称是____;整个操作作为有效除去杂质而不引入新杂质,加入X必须放在加入 BaCl2的___(填“前面”或“后面”).
(2)滤液B中加入适量稀盐酸的目的是_____.
-
科目: 来源: 题型:
查看答案和解析>>【题目】人类的日常生活和工农业生产离不开水和溶液。请回答下列问题:
(1)如图所示,三个实验分别用到水。
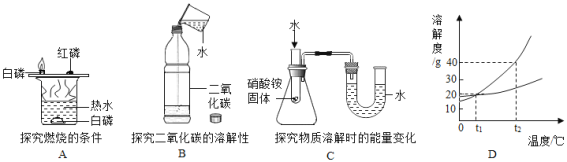
请回答:
①实验A中热水的作用是提供热量和________。
②实验B能说明CO2可溶于水,同时发生的化学反应方程式为______ 。
③实验C,滴加水后看到U型管中______(填“左边”或“右边”)液面升高。
(2)如图D是甲乙两种物质的溶解度曲线(不含结晶水)请回答下列问题:
①t1℃时,甲的溶解度是_____。 ②下列说法一定正确的是_______
A.甲的溶解度比乙的溶解度大
B.t1℃时,甲、乙的饱和溶液的溶质的质量分数相等
C.常温下,乙易溶于水
D.从t2℃降至t1℃,甲、乙溶液中均有晶体析出
③某同学设计的鉴别甲、乙固体的方案如下:t2℃时,取4.0g甲和4.0g乙分别放入两只小烧杯中,各加入10mL水(水的密度为1g/mL),用玻璃棒充分搅拌后,观察现象。你认为此方案是否可行?并说明理由____。
④甲中混有少量的乙,要提纯甲,实验步骤:加水溶解,蒸发浓缩,__________,然后过滤。
-
科目: 来源: 题型:
查看答案和解析>>【题目】一定条件下,蜡烛在一瓶空气中燃烧。利用O2传感器,测定燃烧过程中O2的体积分数,变化如下图所示,下列说法不正确的是
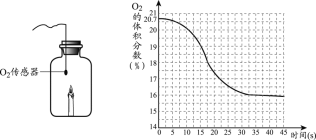
A. 蜡烛燃烧需要氧气
B. 蜡烛熄灭后,密闭容器中还有氧气
C. 蜡烛燃烧前,密闭容器中氧气的体积分数小于21%
D. 蜡烛熄灭后,密闭容器中的二氧化碳体积分数为84%
-
科目: 来源: 题型:
查看答案和解析>>【题目】KNO3和NH4Cl的溶解度曲线如图所示,由图获得的信息中,不正确的是
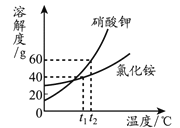
A. 两种物质的溶解度均随温度的升高而增大
B. t1℃时,NH4Cl饱和溶液中溶质与溶液的质量比为2:5
C. t2℃时,KNO3饱和溶液比NH4Cl饱和溶液的溶质质量分数大
D. t1℃时,KNO3溶解度大于NH4Cl溶解度
相关试题

