【题目】有一包白色粉末,可能含有Na2CO3、Na2SO4、K2SO4、KCl、Ba(OH)2中的一种或几种,为了探究其成分,实验过程如图所示,关于该实验的说法中,正确的是()
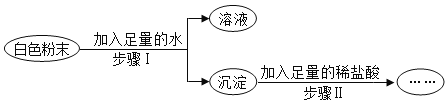
A.步骤Ⅱ中沉淀不溶解,则原白色粉末一定有K2SO4,一定没有Na2CO3
B.步骤Ⅱ中沉淀全部溶解,则原白色粉末一定有Ba(OH)2、Na2CO3,可能有KCl
C.步骤Ⅱ中沉淀部分溶解,则原白色粉末一定有Ba(OH)2、Na2CO3、K2SO4
D.步骤Ⅱ中沉淀部分溶解,则原白色粉末的组成可能有3种情况.
参考答案:
【答案】B
【解析】
碳酸钠和氢氧化钡会生成溶于酸的碳酸钡沉淀,硫酸钠、硫酸钾会与氢氧化钡反应生成不溶于酸的硫酸钡沉淀,所以
A、步骤Ⅱ中沉淀不溶解,说明沉淀只有硫酸钡,则原白色粉末一定有氢氧化钡,一定没有碳酸钠,可能含有硫酸钠和硫酸钾中的至少一种,故错误;
B、步骤Ⅱ中沉淀全部溶解,说明沉淀只有碳酸钡,则原白色粉末一定有氢氧化钡、碳酸钠,题中的现象不能确定是否含有氯化钾,故正确;
C、步骤Ⅱ中沉淀部分溶解,说明沉淀有碳酸钡和硫酸钡,则原白色粉末一定有氢氧化钡、碳酸钠,可能含有硫酸钠、硫酸钾中的一种或两种,故错误;
D、步骤Ⅱ中沉淀部分溶解,则原白色粉末的组成可能有氢氧化钡、碳酸钠、硫酸钠;氢氧化钡、碳酸钠、硫酸钾;氢氧化钡、碳酸钠、硫酸钾、硫酸钠;氢氧化钡、碳酸钠、硫酸钠、氯化钾;氢氧化钡、碳酸钠、硫酸钾、氯化钾;氢氧化钾、碳酸钠、硫酸钾、硫酸钠、氯化钾6种情况,故错误。
故选:B。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列实验方案或操作不正确的是( )
A.
 证明CO2与NaOH溶液发生了反应
证明CO2与NaOH溶液发生了反应B.
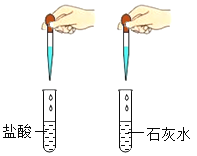 用碳酸钠溶液鉴别盐酸和石灰水
用碳酸钠溶液鉴别盐酸和石灰水C.
 将10%的KNO3溶液变为5%的KNO3溶液
将10%的KNO3溶液变为5%的KNO3溶液D.
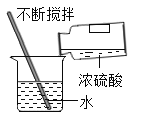 稀释浓硫酸
稀释浓硫酸 -
科目: 来源: 题型:
查看答案和解析>>【题目】氯化铵和硝酸钾溶解度曲线如图所示,下列叙述正确的是( )
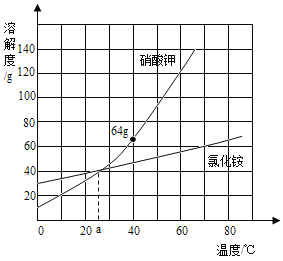
A.硝酸钾的溶解度比氯化铵的大
B.a℃时,氯化铵与硝酸钾溶液中溶质的质量分数相等
C.将20℃的硝酸钾不饱和溶液升温可以变为饱和溶液
D.40℃时,50g水中加入50g硝酸钾,充分搅拌,得到质量分数为39.02%的硝酸钾溶液
-
科目: 来源: 题型:
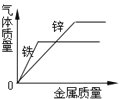
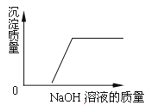
查看答案和解析>>【题目】下列曲线能正确表达对应的反应或过程的是( )
A. NH4NO3固体溶于水
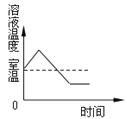
B. 煅烧石灰石

C. 等质量等浓度的稀H2SO4加入金属
D. CuSO4和H2SO4混合液中加入NaOH溶液
-
科目: 来源: 题型:
查看答案和解析>>【题目】日前,东南大学教师首创“南京地铁车厢速查表”走红网络。地铁是指在地下运行为主的城市轨道交通系统,地铁建设中各种材料被广泛应用。
(1)地铁站的排水管采用聚乙烯塑料管道,聚乙烯塑料属于__________(填“金属材料”或“合成材料”)。
(2)施工中挖掘岩石的机械刀片用钨钢制成,据此推测钨钢具有的一条物理性质______________________________。
(3)科研人员研制出的钢轨防锈涂料主要是为了防锈,其原理是_________________________。
(4)地铁隧道中常用氢氧化镁作为阻燃材料,其阻燃原理是受热分解生成水蒸气和耐高温的氧化镁,该反应的化学方程式是_________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】根据所学知识并结合下图回答有关问题。
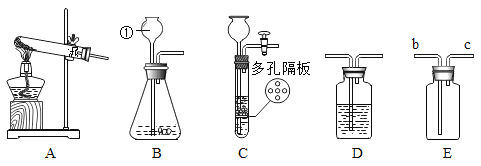
(1)写出标号①仪器名称______。
(2)实验室可用高锰酸钾制取氧气,应选用上述装置_____作为发生装置,反应的化学方程式为______________。如果用E装置收集O2,则验满的方法是_________。
(3)实验室常用锌与稀硫酸为原料制取H2,其反应的化学方程式为_____。若要获得干燥的H2,除发生装置外,还应选用D装置,并在该装置中盛放_____(填写试剂名称),若制取0.4gH2,理论上需要________g10%的稀硫酸与足量锌反应。
(4)小睿和小琦两位同学用下图所示装置进行实验,验证二氧化碳与氢氧化钠、氢氧化钙都能发生反应。
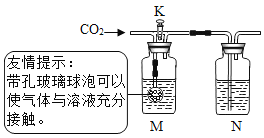
①小琦先关闭K,通入二氧化碳,M、N中均无明显变化,M中盛放______溶液。
②小琦再打开K,继续通入二氧化碳,N中反应的化学方程式为______。此步实验目的__________。小睿认为:通常状况下,1体积的水约能溶解1体积二氧化碳,因此上述实验不足以证明二氧化碳和氢氧化钠发生了反应。
③小睿用洗涤干净的上述装置重新实验,分别量取50 mL上述溶液放入M、N中,关闭K,通入约500 mL二氧化碳,M、N中均无明显变化。此实验可以说明二氧化碳和氢氧化钠发生了反应,其理由是____________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】二氧化氯(ClO2)可用于自来水消毒。以粗盐为原料生产ClO2的工艺主要包括:
①反应Ⅰ是粗盐除杂;
②反应Ⅱ是特殊条件下电解NaCl溶液制NaClO3;
③反应Ⅲ是ClO2的制取。其中反应Ⅲ制取ClO2的化学方程式为:2NaClO3+4HCl═2ClO2↑+Cl2↑+2NaCl+2H2O。
工艺流程如图,
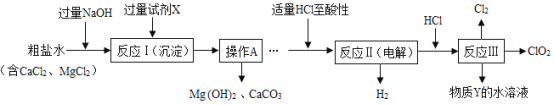
(1)加入过量氢氧化钠的目的是________。
(2)过量的试剂X是____(填化学式),操作A的名称是_______。
(3)求出沉淀ClO2中Cl的化合价为_______。
(4)加入适量HCl除为了满足电解时的微酸性外,还能除去溶液中的杂质离子,请写出其中所发生的中和反应的化学方程式:___________。
(5)该流程中可循环利用的物质是水和________。
相关试题

