【题目】有一包白色固体样品,可能含碳酸钠、硫酸钠、氯化钠、氢氧化钠中的一种或几种。小科同学为探究其成分做了以下实验:
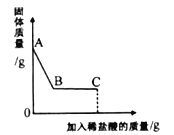
Ⅰ.取少量固体样品于烧杯中,先加足量水溶解,再加入足量的BaCl2溶液,有白色沉淀产生;
Ⅱ.继续向烧杯中滴加稀盐酸并不断搅拌,烧杯内固体质量随加入稀盐酸质量的变化如图所示。
请回答下列问题:
(1)AB段观察到的现象是 。
(2)C点时,溶液中一定含有的溶质是 。
参考答案:
【答案】(1)固体部分溶解并有气泡产生
(2)NaCl、BaCl2、HCl
【解析】(1)AB段沉淀质量减少,说明加入稀盐酸后沉淀部分溶解并生成气体。故AB段观察到的现象是:固体部分溶解并有气泡产生;
(2)加入稀盐酸后沉淀部分溶解,说明加入BaCl2溶液生成碳酸钡沉淀和硫酸钡沉淀。在生成沉淀的同时生成氯化钠。稀盐酸与碳酸钡反应生成氯化钡。又C点时稀盐酸过量。故C点时,溶液中一定含有的溶质是NaCl、BaCl2、HCl。
-
科目: 来源: 题型:
查看答案和解析>>【题目】(1)如图是实验室制取气体的一些装置,据图回答:
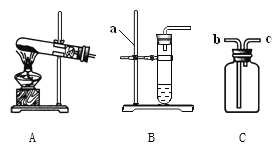
①图B中仪器a的名称是________________。
②用高锰酸钾制取氧气的发生装置是_____________(填序号),若用C装置手机氧气,验满时,应将带木星的木条放在_____________(填“b”或“c”)端导口,若木条复燃,说明氧气已满。
(2)小明在帮老师整理实验室时,发现一瓶为密封的KOH固体,对其成分提出以下假设,并在老师的指导下进行实验探究。
[查阅资料]:①KOH与NaOH的化学性质相似。请用化学方程式解释KOH变质的原因是____________。
②K2CO3溶液呈碱性,BaCl2溶液、KCl溶液呈中性。
[猜想假设]:假设Ⅰ:只含KOH;假设Ⅱ:含KOH和K2CO3;假设Ⅲ:只含K2CO3
[进行实验]:
实验操作步骤
实验现象
实验结论
① 取少量样品于试管中,加入足量的稀盐酸
有气泡产生
假设______不正确
② 另取少量样品于试管中,加水溶解,加入过量的BaCl2溶液,振荡,静置
—————————
假设Ⅲ正确
③ 取②中上层清液,滴加无色酚酞溶液
—————————
[问题讨论]:步骤②中加入过量BaCl2溶液的作用是_____________________。
[拓展应用] :完全变质的KOH也有利用价值,从K2CO3的组成或性质看,这瓶变质的试剂在农业上的用途是_________________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某化学兴趣小组欲测定一瓶过氧化氢溶液中溶质的质量分数,实验操作及相关数据如图所示:
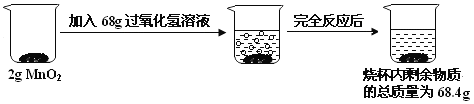
(1)生产氧气的质量_________g;
(2)这瓶过氧化氢溶液中溶质的质量分数是多少?(写出计算过程)
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列属于化学变化的是
A.冰雪融化 B.矿石粉碎 C.纸张燃烧 D.水分蒸发
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图为实验室制取某些气体的装置示意图,据此回答有关问题

(1)写出图中序号①的仪器名称_________________。
(2)实验室用双氧水和二氧化锰制取氧气,反应的化学方程式为_____________;其中二氧化锰的作用是___________________________;若选用E装置收集氧气,气体应从______端(填a或b)进入。
(3)检查A装置气密性的方法为______________________________。
(4)通常状况下,甲烷是一种无色无味气体、难溶于水、密度比空气小。实验室常用醋酸钠和碱石灰两种固体混合加热制得,制取并收集甲烷可选用的装置是_________。(填字母)
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列属于氧化物的是
A. Fe B.CH4 C. SO2 D.Na2C03
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列由分子构成的是
A.水 B.镁 C.金刚石 D.氢氧化钠
相关试题

