【题目】如图所示,往水电解器中加入96g蒸馏水和2g Na2SO4(Na2SO4不参与反应,仅起增加水的导电性的作用)组成的混合物,然后进行电解,当负极得到2g气体时,停止实验(所需相对原子质量:H﹣1、O﹣16).
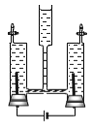
计算:
(1)停止实验时,电解消耗水的质量是多少?
(2)停止实验后,剩余溶液中Na2SO4的质量分数是多少?
参考答案:
【答案】(1)18g (2)2.5%
【解析】电解水实验中正极产生的是氧气,负极得到的是氢气,根据题意可知氢气的质量为2g;
(1)设生成2g氢气消耗的水的质量为x
2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
36 4
x 2g
![]() =
=![]()
x=18g
(2)由于过程中硫酸钠仅起增加水的导电性的作用,相当于是本反应的催化剂,其质量保持不变,故剩余溶液中Na2SO4的质量分数为![]() ×100%=2.5。%
×100%=2.5。%
答:(1)停止实验时,电解消耗水的质量是18g;(2)停止实验后,剩余溶液中Na2SO4的质量分数是2.5%。
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验室利用下列装置制取并收集O2(试管中的棉花反应的需要选择是否添加).
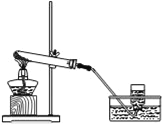
(1)若要顺利制得O2,除选择KClO3与MnO2混合物作为药品外,还可以选择的药品是_______(填化学式).
(2)如果选择KClO3与MnO2混合物作为制备O2的药品,则反应后MnO2的质量将________(填“增加”、“减小”或“不变”等).
(3)简述检查该装置气密性的方法___________________________________.
-
科目: 来源: 题型:
查看答案和解析>>【题目】某实验小组的甲、乙两同学围绕Na2CO3进行了如图一所示的实验.实验结束后,丙同学把A、B两支试管中的物质倒入同一洁净的烧杯中(如图二),充分混合后发现白色沉淀明显增加.
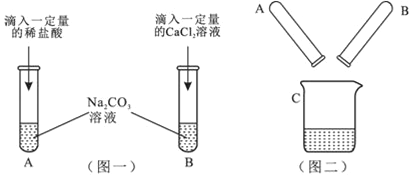
(1)甲同学的实验完成后,A试管一定有剩余的物质是_____________.
(2)乙同学的实验发生的化学方程式是_____________________.
小组同学将C中液体过滤后,对所得滤液的主要成分进行了如下探究:
【猜想与假设】实验小组的同学对滤液的成分作出了如下猜想:
猜想一:滤液中的溶质是NaCl、Na2CO3
猜想二:滤液中的溶质是NaCl、CaCl2
猜想三:滤液中的溶质是NaCl、CaCl2、HCl
猜想四:滤液中的溶质是NaCl
【讨论与交流】通过认真讨论,小组同学排除了其中一种不合理的猜想.
(3)你认为不合理的猜想是__________,理由是_____________________________________.
【进行实验】丁同学取少量滤液置于试管中,向试管中滴加一种物质,发现有无色气泡生成.
(4)你认为丁同学向滤液中滴加的物质是__________________.
【实验结论】通过探究,小组同学得出了猜想一是正确的结论.
-
科目: 来源: 题型:
查看答案和解析>>【题目】“鱼米之乡”益阳盛产的谷物类粮食(如大米)品种多样,特种水产品(如小龙虾、甲鱼等)也名扬全国。
(1)大米中含有的主要营养物质是________;小龙虾、甲鱼中含有的主要营养物质是________(填名称)。
(2)谷物类粮食在人体内经酶的催化作用转化为葡萄糖(C6H12O6)而被人体吸收。在人体组织里,葡萄糖在酶的作用下生成CO2和H2O,同时放出能量供机体活动和维持体温。写出后一个反应的化学方程式_____________________________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】.为测定某石灰石样品中碳酸钙的质量分数,某同学取30g石灰石样品,把200g稀盐酸逐次加入其中,实验数据如下:
第一次
第二次
第三次
第四次
稀盐酸质量/g
50g
50g
50g
50g
余下固体质量/g
20g
10g
9g
9g
试求:(1)此石灰石样品的纯度。(2)200g稀盐酸中所含氯化氢的质量。
-
科目: 来源: 题型:
查看答案和解析>>【题目】今有A、B、C、D、E五种装置如右图所示。
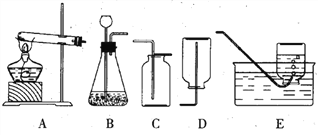
按下列要求回答问题(所选装置用其代号字母表示)
(1)实验室用高锰酸钾的加热分解来制取氧气时,发 生装置选用_____,收集装置选用_____,该装置制取氧气的化学方程式为__________________________。
(2)实验室用大理石和稀盐酸来制取二氧化碳时,发生装置选用_____,收集装置选用_____,该制取二氧化碳的化学方程式为__________________________________________。
(3)硫化氢是一种无色且有臭鸡蛋气味的气体,能溶于水,可形成一种酸溶液——氢硫酸。实验室用硫化亚铁跟稀硫酸反应制取硫化氢气体。试回答:
①硫化氢气体具有臭鸡蛋气味,这是硫化氢的___________(填“物理”或“化学”)性质。
②硫化氢的水溶液能使石蕊试液变_________色。
③实验室制取H2S气体时,发生装置应选用_____,收集装置应选用_________(填仪器编号)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】一种元素与另一种元素的本质区别是( )
A.核电荷数 B.电子数 c.中子数 D.最外层电子数
相关试题

