【题目】木炭粉还原氧化铜实验后的混合粉末中含有铜、氧化铜、少量木炭粉,实验室从该混合粉末中回收铜的方案如下(已知CuO+H2SO4=CuSO4+H2O,木炭粉不与稀H2SO4反应)。
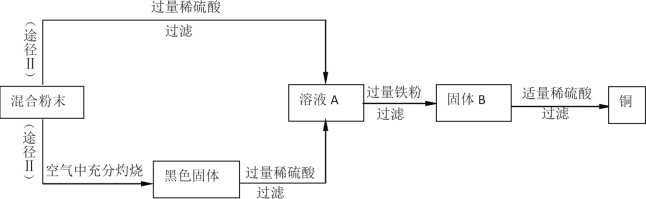
请根据流程图,回答下列问题:
(1)过滤操作中用到的玻璃仪器有烧杯、玻璃棒和___________,玻璃棒的作用是________。
(2)固体B所含的物质是________(填物质化学式),溶液A加入过量铁粉的化学方程式是______(任写一个)。
(3)检验得到的铜是否含铁粉的的操作是___________________________。
(4)途径Ⅱ与途径Ⅰ比较,Ⅱ优点是______________________________。
参考答案:
【答案】漏斗 引流,防止液滴飞溅(填引流就得分) Fe、Cu(错漏得0分) Fe+H2SO4=FeSO4+H2↑ (或Fe+CuSO4=FenSO4+Cu 取得到的铜于试管中,加入稀盐酸(或取得到的铜,用磁铁吸引,操作合理就得分) 得到更多的铜(或使混合物中的铜元素全部回收)。
【解析】
(1)依据过滤操作的实验操作分析解答;
(2)依据溶液A的成分以及与铁粉反应的情况分析解答;
(3)依据铁粉能与稀硫酸反应产生气泡分析解答;
(4)根据途径Ⅱ直接除去木炭粉和铜的转化进行解答。
(1)从过滤的操作情况分析可知过滤操作中用到的玻璃仪器有烧杯、玻璃棒和漏斗,玻璃棒的作用是引流;
(2)根据反应流程及反应物和生成物分析,固体B所含的物质是被铁置换出的铜和剩余的铁,其化学式为:Fe、Cu;氧化铜与硫酸反应生成硫酸铜和水,过滤后的滤液中加入铁粉,硫酸铜和铁粉反应生成硫酸亚铁和铜,方程式为:Fe+CuSO4═FeSO4+Cu;
(3)检验得到的铜是否含铁粉的操作是:取少量固体滴入稀硫酸,观察是否有气泡产生,有气泡产生即为有铁粉,否则没有;
(4)途径Ⅱ与途径Ⅰ比较,Ⅱ的优点是直接除去木炭粉,简化了实验步骤,同时混合物中的铜加热后可以转化为氧化铜,且氧化铜可以与稀硫酸反应生成硫酸铜,从而使最终制得的铜的量变多。
-
科目: 来源: 题型:
查看答案和解析>>【题目】金属及金属材料在日常生活中应用广泛。
(1)下列生活用品中,主要利用金属导热性的是_____________(填字母序号)。

(2)工业上用一氧化碳还原氧化铁的化学方程式为__________________。
(3)R是银白色金属,将稀盐酸分别加入到盛有金属Fe、R、Cu的试管中,只有Cu表面无现象;将 FeSO4溶液中分别加入到盛有金属R、Cu的试管中,只有R表面有黑色物质析出,则金属H、Fe、R、Cu活动性由强到弱的顺序是__________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】根据下列有关实验,回答问题

(1)甲是空气中氧气含量测定的两个实验,实验时发现实验B测量更准确,原因是__________,用A实验时若燃烧匙盛放木炭,实验不成功的原因是_________。
(2)乙实验燃烧着的两根蜡烛,先熄灭的是_________(选填“c”或“d”),原因是_________。
(3)如图甲,把盛满CO2的试管倒立在水中,观察到的现象是_______________,产生此现象的原因是_________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】A~F分别是碳、氢、氧三种元素中的一种或两种组成的常见物质,它们之间的关系如图所示(箭头表示物质间能转化,实线表示物质间能反应)

A为固体单质,D为液体。请回答:
(1)若F常温下是液体,则B的化学式为____________, E→F的化学方程式是_________,B+E反应的基本类型是_______。
(2)若F常温下是气体单质,D→E的化学方程式是__________, A→B是置换反应,该反应的化学方程式是________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】有下列的装置和仪器,回答有关问题。

(1)仪器①的名称是________。
(2)图A是实验室用高锰酸钾制取氧气的装置,请指出图中错误的地方_______,改正时应该调节的螺丝是________(选填“a”、“b”或 “c”),装置改正后试管中发生反应的化学方程式是___________。若用如图甲测定产生的氧气的体积,则导管口的连接顺序是:A产生的气体→____→____→f(填写字母代号)。

(3)实验室用过氧化氢溶液分解制取O2,若要控制反应速率获得平稳气流,应选用______(从A至D选填序号)作为气体发生装置。
(4)B装置作为制取CO2的发生装置时,可以随时控制的反应停止和发生。从E至H选择________(填序号,夹持装置省略)也可以组装成一个可随时使反应停止和发生的气体发生装置。用右图乙所示矿泉水瓶可以证明CO2能溶于水,其现象是_________,此时打开瓶盖,向瓶中滴入紫色石蕊试液,观察到__________现象,证明CO2能与水反应。

-
科目: 来源: 题型:
查看答案和解析>>【题目】兴趣小组同学发现实验室一片久置的铜片表面附着有一层绿色固体,查阅资料得知绿色固体是铜绿 [化学式为Cu2(OH)2CO3],甲同学从铜片上刮下一些铜绿进行如下探究,请填写下表中空白:
实验步骤
实验现象
实验结论
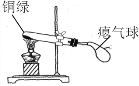 取少量铜绿在下图装置中加热。
取少量铜绿在下图装置中加热。试管内壁有水雾。
铜绿加热产生_________。
_________________。
铜绿加热后生成氧化铜。
气球胀大。
乙同学对气球胀大产生兴趣,于是进行了如下的探究。
(发现问题) 气球为什么会胀大?
(提出猜想) 猜想Ⅰ:试管内的空气受热膨胀使气球胀大;
猜想Ⅱ:铜绿加热产生二氧化碳使气球胀大;
猜想Ⅲ:铜绿加热产生一氧化碳使气球胀大;
猜想Ⅳ:铜绿加热产生一氧化碳和二氧化碳混合气体使气球胀大。
(实验与分析)①熄灭酒精灯后,气球依然胀大没有变瘪,证明猜想___________不成立。
②乙同学用下图装置进行实验:
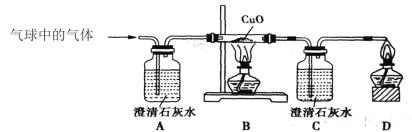
乙同学发现___________________,说明铜绿加热后有CO2产生,产生此现象的化学方程式是________,B处试管内的氧化铜没有变化,说明猜想___________不成立。
(实验结论)猜想Ⅱ成立。
(反思)
(1)加热铜绿反应的化学方程式是__________________。
(2)丙同学认为乙同学如果省略A可达到相同的结论,具体的操作是______________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】环丙沙星片是常用的一种抗生素,其说明书中的部分内容如图。
环丙沙星片
[化学式] C17H18FN3O3
[规 格] 0.25g/片(按环丙沙星计)
[贮 存] 遮光
环丙沙星片
[化学式] C17H18FN3O3
[规 格] 0.25g/片(按环丙沙星计)
[贮 存] 遮光
(1)根据说明书可知,环丙沙星具有的化学性质是_________。
(2)环丙沙星的相对分子质量是________。
(3)环丙沙星中碳、氢、氧元素的质量比是_____。
(4)环丙沙星中氮元素的质量分数是_______。
相关试题

