【题目】我国北方某盐湖生产的纯碱产品中常含有少量的氯化钠(其他杂质忽略不计).为测定该产品中碳酸钠的质量分数,现称取6 g试样放在烧杯中并滴加稀盐酸.当盐酸滴加至36.5 g时,烧杯内溶液的总质量为40.3 g(假设产生的气体全部逸出),产生气体的质量与滴入稀盐酸的质量关系如图所示.试计算:
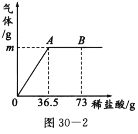
(1)A点产生气体的质量m=___________.
(2)试样中碳酸钠的质量分数_______(结果精确至0.1%).
(3)B点时,烧杯内溶液中的溶质是___________(写出化学式).
参考答案:
【答案】2.2g 88.3% NaCl、HCl
【解析】
(1)根据产生气体的质量与滴入稀盐酸的质量关系图,A点时碳酸钠与盐酸恰好完全反应,之后再加稀盐酸为过量不再发生反应,因此,根据质量守恒定律,利用最终烧杯内溶液总质量与反应前所加各物质总质量的差值,可求得放出二氧化碳质量;
(2)根据反应的化学方程式,由恰好完全反应放出二氧化碳的质量,可计算样品中所含有碳酸钠的质量,该质量与样品质量比可计算试样中碳酸钠的质量分数;
(3)至A点恰好完全反应后,所加稀盐酸过量就不再发生反应,因此,至B点时因盐酸过量,所得溶液为氯化钠和稀盐酸的混合溶液。
根据质量守恒定律,A点产生气体的质量=36.5g+6g-40.3g=2.2g;
故答案为:2.2g;
(2)设样品中碳酸钠的质量为x

样品中碳酸钠的质量分数=![]() ×100%≈88.3%
×100%≈88.3%
即试样中碳酸钠的质量分数为88.3%.
(3)B点时所加稀盐酸过量,所得溶液为氯化钠与稀盐酸的混合溶液,其中溶质为NaCl、HCl;
答案:(1)2.2g(2)试样中碳酸钠的质量分数为88.3%(3)NaCl、HCl。
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图表示X、Y、Z三种物质的溶解度曲线,下列说法正确的是(_____)
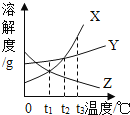
A X中含有少量Y,用海水晒盐的原理提纯X.
B t1℃时,三种物质的饱和溶液升温到t2℃,溶液中溶质质量分数的大小关系是Y>X>Z.
C t3℃时,X、Y的饱和溶液降温到t2℃,析出晶体较多的是X.
D t3℃时,等质量的X、Y分别配成该温度下的饱和溶液,所得溶液质量关系 ________.
-
科目: 来源: 题型:
查看答案和解析>>【题目】某热电厂用脱硫得到的石膏(CaSO4·2H2O)生产K2SO4肥料的流程如图:
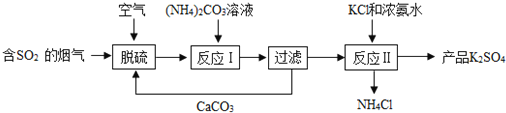
(1)脱硫过程中可用_____喷淋烟气来吸收SO2.
(2)石膏与饱和(NH4)2CO3溶液相混合,发生反应Ⅰ时需不断搅拌,其目的是____
(3)上述流程中可循环使用的物质是______(填写化学式);
(4)用饱和K2SO4溶液洗涤反应Ⅱ所得晶体,不用水洗涤的原因是_____.
-
科目: 来源: 题型:
查看答案和解析>>【题目】在中考化学实验操作考试中,有一题目是鉴别碳酸钠溶液和氢氧化钠溶液,小红等几位同学进行了如图所示的实验.
(1)写出试管②中碳酸钠与澄清石灰水反应的化学方程式: _______ .
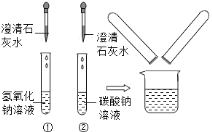
(2)实验结束后,小红同学将①、②两支试管中的废液倒入同一个干净的烧杯中,看到废液浑浊,就对废液进行了过滤,小红等几位同学对滤液的成分又进行了探究.
(提出问题)滤液中除水外还含有哪些物质?
(猜想)小红认为:只含氢氧化钠;
小明认为:可能含有氢氧化钠、碳酸钠和氢氧化钙;
小亮认为:可能含有氢氧化钠和碳酸钠;
你认为:可能含有氢氧化钠和_______. (写一种猜想).
(讨论)你认为小红、小明、小亮三位同学中谁的猜想不合理,请说明理由_____________.
(实验设计)设计一个简单的实验证明你的猜想正确.
实验步骤
实验现象
实验结论
取样于试管中,___
___________
你的猜想正确
(反思拓展)
①在分析化学反应后所得溶液中溶质的成分时,除考虑生成物外还需考虑_____.
②通过以上探究,你认为应怎样处理上述实验后的废液才能倒入下水道?_______.
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图所示的化学实验基本操作正确的是( )
A. 检查装置气密性
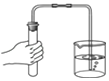 B. 加热液体
B. 加热液体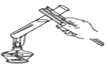
C. 滴加液体
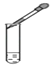 D. 点酒精灯
D. 点酒精灯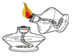
-
科目: 来源: 题型:
查看答案和解析>>【题目】用“
 ”和“
”和“ ”代表两种不同的单质分子,它们在一定条件下能发生化学反应,反应前后的模拟模型如下图所示,下列说法正确的是( )
”代表两种不同的单质分子,它们在一定条件下能发生化学反应,反应前后的模拟模型如下图所示,下列说法正确的是( )
A.参加反应的“
 ”和“
”和“ ”分子的个数比是2:1
”分子的个数比是2:1B.该反应是化合反应
C.该反应有2种生成物
D.每个生成物分子由3个原子构成
-
科目: 来源: 题型:
查看答案和解析>>【题目】用化学用语填空:
(1)2个亚铁离子___
(2)标出过氧化氢中氧元素的化合价___
(3)4个硫酸根离子___
(4)画出钙原子的结构示意图___
(5)保持二氧化碳化学性质的最小的粒子是___
(6)地壳中含量最高的金属元素和含量最高的非金属元素与空气中含量最高的元素组成的化合物___
相关试题

