【题目】在中考化学实验操作考试中,有一题目是鉴别碳酸钠溶液和氢氧化钠溶液,小红等几位同学进行了如图所示的实验.
(1)写出试管②中碳酸钠与澄清石灰水反应的化学方程式: _______ .
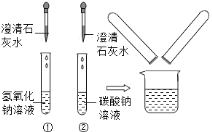
(2)实验结束后,小红同学将①、②两支试管中的废液倒入同一个干净的烧杯中,看到废液浑浊,就对废液进行了过滤,小红等几位同学对滤液的成分又进行了探究.
(提出问题)滤液中除水外还含有哪些物质?
(猜想)小红认为:只含氢氧化钠;
小明认为:可能含有氢氧化钠、碳酸钠和氢氧化钙;
小亮认为:可能含有氢氧化钠和碳酸钠;
你认为:可能含有氢氧化钠和_______. (写一种猜想).
(讨论)你认为小红、小明、小亮三位同学中谁的猜想不合理,请说明理由_____________.
(实验设计)设计一个简单的实验证明你的猜想正确.
实验步骤 | 实验现象 | 实验结论 |
取样于试管中,___ | ___________ | 你的猜想正确 |
(反思拓展)
①在分析化学反应后所得溶液中溶质的成分时,除考虑生成物外还需考虑_____.
②通过以上探究,你认为应怎样处理上述实验后的废液才能倒入下水道?_______.
参考答案:
【答案】Na2CO3+Ca(OH)2═CaCO3↓+2NaOH 氢氧化钙 小明猜想不合理,因为Na2CO3和Ca(OH)2能发生反应,不能共存 通入二氧化碳气体 试管中出现白色沉淀 反应物是否有剩余 在废液中加酸至溶液的pH=7
【解析】
(1)根据反应物、生成物以及反应原理书写方程式;
(2)猜想:根据碳酸钠和氢氧化钙反应时,可能刚好完全反应,也可能其中的一种过量,结合题中的猜想进行分析;
讨论:根据碳酸根离子和钙离子会生成沉淀进行分析;
实验设计:根据猜想,由氢氧化钙的特性,只要设计实验能验证氢氧化钙存在即可;
反思拓展:根据上面的分析可知废液显碱性,不能直接排入下水道进行分析。
(1)碳酸钠和氢氧化钙反应生成白色的碳酸钙沉淀和氢氧化钠,反应的方程式为:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;
故填:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;
(2)[猜想]根据反应原理可知,两者可能恰好完全反应,也可能其中的一种过量,结合已有的猜想,故猜想为:氢氧化钠和氢氧化钙;故填:氢氧化钙;
[讨论]碳酸根离子和钙离子会直接反应生成碳酸钙沉淀。所以,小明猜想不合理,因为Na2CO3和Ca(OH)2能发生反应,不能共存;
故填:小明猜想不合理,因为Na2CO3和Ca(OH)2能发生反应,不能共存;
[实验设计]由于氢氧化钙溶液能与二氧化碳反应生成沉淀,所以,设计实验如下:
实验步骤 | 实验现象 | 实验结论 |
取样品于试管中,通入二氧化碳气体 | 试管中出现白色浑浊 | 你的猜想正确 |
故答案为:
实验步骤 | 实验现象 | 实验结论 |
取样于试管中,通入二氧化碳气体 | 试管中出现白色沉淀 | 你的猜想正确 |
[反思拓展]①根据上面的实验可知:在分析化学反应后所得物质的成分时,除考虑生成物外还需考虑反应物是否过量;
故填:反应物是否有剩余;
②根据上面的检验可知溶液显碱性,一般中性的溶液才能排入下水道中,故处理的措施是:在废液中加酸至溶液的pH=7。
故填:在废液中加酸至溶液的pH=7。
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图所示A-G是初中化学常见的物质.图中“→”表示转化关系,“―”表示相互能反应.已知A是人体胃液中含有的酸,B和C含有相同的元素,D是铁锈的主要成分,F是常见的溶剂,

(1)G的化学式为_______;(2)E是用途:______;
(3)C和D之间的反应需要高温条件,写出它们发生反应的化学方程式:________;
(4)A和E发生反应的化学方程式是 __________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图表示X、Y、Z三种物质的溶解度曲线,下列说法正确的是(_____)
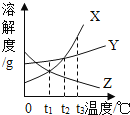
A X中含有少量Y,用海水晒盐的原理提纯X.
B t1℃时,三种物质的饱和溶液升温到t2℃,溶液中溶质质量分数的大小关系是Y>X>Z.
C t3℃时,X、Y的饱和溶液降温到t2℃,析出晶体较多的是X.
D t3℃时,等质量的X、Y分别配成该温度下的饱和溶液,所得溶液质量关系 ________.
-
科目: 来源: 题型:
查看答案和解析>>【题目】某热电厂用脱硫得到的石膏(CaSO4·2H2O)生产K2SO4肥料的流程如图:
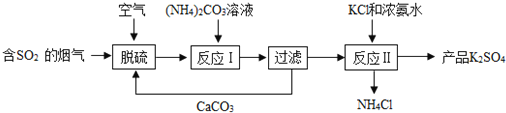
(1)脱硫过程中可用_____喷淋烟气来吸收SO2.
(2)石膏与饱和(NH4)2CO3溶液相混合,发生反应Ⅰ时需不断搅拌,其目的是____
(3)上述流程中可循环使用的物质是______(填写化学式);
(4)用饱和K2SO4溶液洗涤反应Ⅱ所得晶体,不用水洗涤的原因是_____.
-
科目: 来源: 题型:
查看答案和解析>>【题目】我国北方某盐湖生产的纯碱产品中常含有少量的氯化钠(其他杂质忽略不计).为测定该产品中碳酸钠的质量分数,现称取6 g试样放在烧杯中并滴加稀盐酸.当盐酸滴加至36.5 g时,烧杯内溶液的总质量为40.3 g(假设产生的气体全部逸出),产生气体的质量与滴入稀盐酸的质量关系如图所示.试计算:
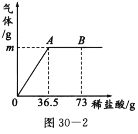
(1)A点产生气体的质量m=___________.
(2)试样中碳酸钠的质量分数_______(结果精确至0.1%).
(3)B点时,烧杯内溶液中的溶质是___________(写出化学式).
-
科目: 来源: 题型:
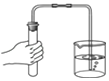
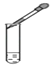
查看答案和解析>>【题目】下图所示的化学实验基本操作正确的是( )
A. 检查装置气密性
 B. 加热液体
B. 加热液体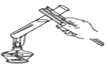
C. 滴加液体
 D. 点酒精灯
D. 点酒精灯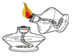
-
科目: 来源: 题型:
查看答案和解析>>【题目】用“
 ”和“
”和“ ”代表两种不同的单质分子,它们在一定条件下能发生化学反应,反应前后的模拟模型如下图所示,下列说法正确的是( )
”代表两种不同的单质分子,它们在一定条件下能发生化学反应,反应前后的模拟模型如下图所示,下列说法正确的是( )
A.参加反应的“
 ”和“
”和“ ”分子的个数比是2:1
”分子的个数比是2:1B.该反应是化合反应
C.该反应有2种生成物
D.每个生成物分子由3个原子构成
相关试题

