【题目】分析处理图表中的信息是学习化学的一种重要方法,运用溶解度表与溶解度曲线回答下列问题:
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 |
NH4Cl溶解度/g | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
NaCl溶解度/g | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
(1)氯化钠的溶解度曲线是 _________(填“甲”或“乙”)。
(2)20℃时,将40g NH4Cl加入100g的水中,充分搅拌后得到的是______溶液(填“饱和”或“不饱和”),将上述溶液升温到30℃,该溶液的溶质质量分数为_______(只列计算式,不需要计算结果)。
(3)如下图,t1℃时,将两种物质的饱和溶液各100g,分别恒温蒸发5g水,析出晶体最多的是______(填“甲”或“乙”)。

(4)计算配制50g质量分数为3%的NaCl溶液所需质量分数为6%的NaCl溶液的体积,需要用到的数据是_____________(填字母)。
A.3%的NaCl溶液的密度 B.水的密度 C.6%的NaCl溶液的密度
参考答案:
【答案】 乙 饱和溶液 ![]() 乙 C
乙 C
【解析】(1)从表中数据可看出,氯化钠的溶解度受温度影响不大,故乙是氯化钠的溶解度曲线。(2)20℃时,NH4Cl的溶解度是37.2g,即20℃时,100g水中最多能溶解37.2gNH4Cl,故将40g NH4Cl加入100g的水中,充分搅拌后得到的是饱和溶液。30℃时,NH4Cl的溶解度是41.4g,40gNH4Cl全部溶解,该溶液的溶质质量分数为: ![]() ×100%(3)将两种物质的饱和溶液各100g,分别恒温蒸发5g水,析出晶体的质量溶解在5g水中恰好饱和,因为t1℃时,乙的溶解度大于甲的溶解度,故析出乙的质量较多。(4)溶液稀释前后溶质的质量相等,溶质质量=溶质质量分数×溶液质量,题中给出了6%的NaCl溶液的体积,需要知道6%的NaCl溶液的密度,然后计算出6%的NaCl溶液的质量,故选C。
×100%(3)将两种物质的饱和溶液各100g,分别恒温蒸发5g水,析出晶体的质量溶解在5g水中恰好饱和,因为t1℃时,乙的溶解度大于甲的溶解度,故析出乙的质量较多。(4)溶液稀释前后溶质的质量相等,溶质质量=溶质质量分数×溶液质量,题中给出了6%的NaCl溶液的体积,需要知道6%的NaCl溶液的密度,然后计算出6%的NaCl溶液的质量,故选C。
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验过程与图像描述相符的一组是( )
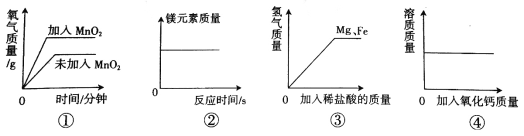
A. ①两份等质量、等溶质质量分数的双氧水在有无MnO2的情况下反应
B. ②镁在装有空气的密闭容器内燃烧
C. ③向等质量的镁、铁中分别加入稀盐酸
D. ④室温下,向一定质量的饱和石灰水中加入氧化钙
-
科目: 来源: 题型:
查看答案和解析>>【题目】金属材料的生产和使用是人类社会文明和进步的重要标志。
(1)下列生活用品,主要是由金属材料制成的是________

(2)制造汽车要用到含铜、铁、铝等成分的多种金属材料。
①在汽车电路中,经常用铜作导线,这是利用了铜的________性。
②车体多用钢材制造,其表面喷漆不仅美观,而且可有效防止与________接触而生锈。
③下列物质不属于合金的是________(填序号)
A.青铜 B.硬铝 C.生铁 D.水银
-
科目: 来源: 题型:
查看答案和解析>>【题目】某金属冶炼厂的管道烟泥中含有某些单质,其中Cu约占10.3%、Zn约占5.0%、S约占1.2%。现欲回收铜和锌,并对硫进行环保处理,主要步骤如下图所示:
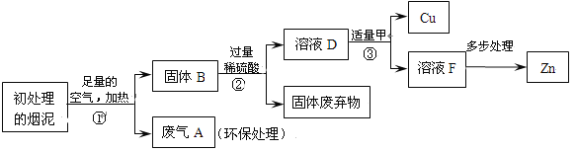
已知:加热的条件下,Zn、Cu都可以与氧气反应生成相应的金属氧化物。
(1)步骤①产生的废气A中,一定含有的有害气体是 。
(2)步骤③中反应的化学方程式是 , 。
(3)下列说法正确的是 。
a.②、③中的操作均包含过滤
b.溶液D和溶液F中ZnSO4的质量相等
c.溶液D中ZnSO4的质量大于CuSO4的质量
d.若步骤①中空气不足量,不会导致锌的回收率降低
-
科目: 来源: 题型:
查看答案和解析>>【题目】硝酸钾溶解度随温度变化的曲线如图所示:
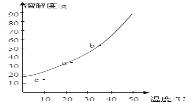
(1)图中abc三点中属于不饱和溶液的是__________________ 。
(2)由c点到a点可采取的措施________________ 。
(3)若KNO3溶液中混有少量的NaCl杂质,可以采取_______方法获得较纯净的KNO3
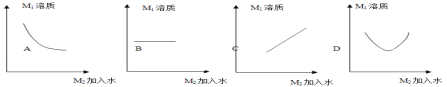
(4)若将b点溶液逐渐加水稀释使其质量分数降至10%,在此稀释过程中符合此溶液中溶质质量变化的规律的图像是________ 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某化学小组向AgNO3和Al(NO3)3的混合溶液加入一定量的铜粉和锌粉,充分反应后过滤,得到溶液甲和固体乙,如图所示,回答下列问题。

(1)固体乙中一定含有____,可能含有________。
(2)若溶液甲为蓝色,则溶液甲中一定含有的金属离子为____(填离子符号);
(3)若向固体乙上滴加盐酸有气泡产生,则溶液甲中一定没有________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】请结合下图回答问题:
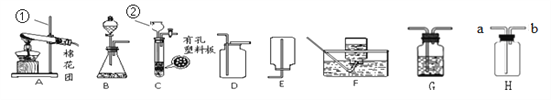
(1)写出图中有标号仪器的名称:①__________,② __________。
(2)用加热高锰酸钾的方法制取氧气,应选用的发生装置是(填字母编号)__________,装入药品前应先__________,写出该反应化学方程式__________。
(3)用B、D装置组合制取二氧化碳气体的化学方程式__________。 若要获得干燥的该气体,除发生、收集装置外,还应选用G装置,并在该装置中盛放__________(填名称)。如果用H装置收集该气体,则气体从__________端进入(填“a”或“b”)。
(4)实验室用锌粒和稀硫酸反应制取H2的化学方程式__________,常选用装置B或C, C与B相比较,C的优点是__________。
(5)实验室使用的稀硫酸通常都是将浓硫酸用水稀释而成的。现欲用98%的硫酸(密度为1.84g/mL)配置19.6%的稀硫酸100 g,需要浓硫酸的体积为__________mL(保留到小数点后一位),量取水时应选用规格(从10mL、50mL、100mL中选取)为__________mL的量筒。
相关试题

