【题目】计算题:
某固体样品可能含有NaCl、NaHCO3、Na2CO3中的一种、二种或三种。某兴趣小组取出100g固体与足量的稀硫酸反应,将产生的气体通入足量的澄清石灰水,生成沉淀100g。然后又取出等质量的样品加水溶解,再加入足量的CaCl2生成沉淀50g(己知:NaHCO3与CaCl2不反应).
(1)该固体样品成分是________。
(2)求该固体样品中Na2CO3质量分数为多少___________?(写出计算过程)
参考答案:
【答案】 NaC1.NaHCO3.Na2CO3 53%.
【解析】碳酸盐、碳酸氢盐能与酸反应生成二氧化碳气体。取100g样品加水溶解,再加入足量的CaCl2溶液,生成沉淀50g,而NaHCO3与CaCl2不反应,所以样品中含有Na2CO3。取出100g固体与足量的稀硫酸反应,将产生的气体通入足量的澄清石灰水,生成沉淀100g,可知样品中含有NaHCO3,设样品中Na2CO3的质量是x。
Na2CO3 + CaCl2 == CaCO3↓+ 2NaCl
106 100
x 50g
![]() =
=![]() ,解得x=53g
,解得x=53g
Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑,NaHCO3 + HCl == NaCl + H2O + CO2↑,CO2 + Ca(OH)2 == CaCO3↓+ H2O
所以100g-50g=50g沉淀是NaHCO3发生有关反应生成的,设样品中NaHCO3的质量是y。
NaHCO3 ---- CaCO3
84 100
y 100g-50g=50g
![]() =
=![]() ,解得y=42g
,解得y=42g
53g+42g=95g<100g,所以样品是由碳酸钠、碳酸氢钠、氯化钠组成的。
(2)固体样品中Na2CO3质量分数为:![]() ×100%=53%
×100%=53%
-
科目: 来源: 题型:
查看答案和解析>>【题目】甲乙丙三种物质均不含结晶水,溶解度曲线如下图所示,下列分析错误的是
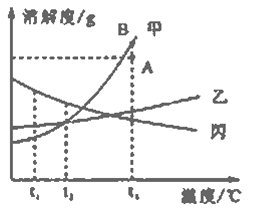
A. 甲中含有杂质乙,可采用加水溶解、蒸发浓缩、冷却结晶、过滤的方法提纯甲
B. 将A点降温到t1℃甲、乙、丙均变为不饱和溶液
C. t2℃时,甲、乙、丙饱和溶液中,丙质量分数最大
D. 将甲中A点变成B点可采用恒温蒸发溶剂的方法
-
科目: 来源: 题型:
查看答案和解析>>【题目】化学使我们的生结丰富多彩,生活中处处有化学。请用化学知识回答下列问题:
(1)画出O2-的结构示意图______。
(2)浓硫酸不慎沾到皮肤上,应立即用大量水冲洗,然后再涂上3%-5%的____(填名称)的溶液。
(3)乙醇______(填“能”或“不能”)导电
(4)干冰_______(填“是“或者“不是”)冰
(5)电解水时加少量NaOH以增强导电性,在电解过程中NaOH不发生反应,则电解后溶液的pH_______ (填”增大”、“减小”或者“不变”)
(6)氧化钙与水反应、镁与盐酸反应均_______(填“放出”或“吸收”)热量。
-
科目: 来源: 题型:
查看答案和解析>>【题目】A~I均为初中化学常见物貭,它们之间的转化关系如下图,部分产物己略去。己知A是人体胃酸的主要成分,B是大理石的主要成分,D为液体,F为气体,I能与A反应生成个数比为1:2的+2价、+3价铁盐。
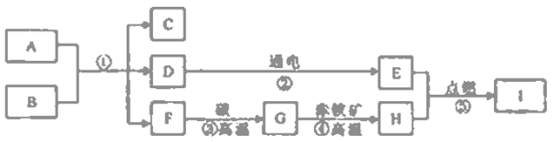
(1)写出下列物质的化学式C________、H_________ 。
(2)上述①②③④⑤中属于化合反应的是________、属于分解反应的是________
(3)写出G→H的化学反应方程式________。
(4)写出I和A反应的化学反应方程式________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】有一溶液是由盐酸、硫酸、硫酸铁、氯化铁、稀硝酸、硝酸铁几种中的两种混合而成,向该溶液中加Ba(OH)2溶液的体积与生成沉淀的质量关系如图所示,则该溶液是 ( )
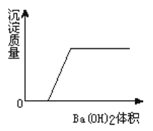
A. 硫酸铁、硝酸铁 B. 硫酸、氯化铁 C. 盐酸、氯化铁 D. 盐酸、硫酸铁
-
科目: 来源: 题型:
查看答案和解析>>【题目】由Na2CO3和CaCO3组成的混合物中,经测定其中碳元素的质量分数为11.65%,则在以下这六个量中:①Na元素的质量分数;②Ca元素的质量分数;③氧元素的质量分数;④CaCO3的质量分数;⑤Na2CO3的质量分数;⑥Na2CO3和CaCO3的质量比.能确定的是( )
A.都不能确定 B.只有③能确定
C.只有④⑤⑥能确定 D.都能确定
-
科目: 来源: 题型:
查看答案和解析>>【题目】在AlCl3溶液中逐滴加入NaOH溶液至过量,发生如下反应:3NaOH+AlCl3=Al(OH)3↓+3NaCl,Al(OH)3+NaOH=NaAlO2+2H2O,NaAlO2易溶于水。下列图像不正确的是 ( )
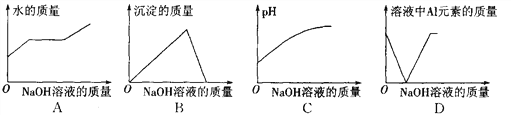
A. A B. B C. C D. D
相关试题

