【题目】将海水进行处理后可以获得精盐。海水中,除氯化钠外,还含有氯化镁、氯化钙、硫酸钠等杂质,对其处理的主要流程如下:
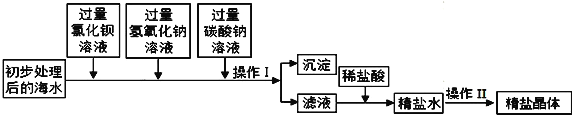
(1)操作Ⅰ的名称是_____;
(2)加入过量BaCl2溶液发生反应的化学方程式是 _________;
(3)加入碳酸钠溶液的目的是______;若Na2CO3与BaCl2顺序颠倒则最后所得的精盐水中除NaCl外还含有______(填化学式)
(4)向滤液中滴加适量稀盐酸的目的是__,请写出稀盐酸与该滤液中物质反应的一个化学方程式___。
参考答案:
【答案】过滤 BaCl2+Na2SO4=BaSO4↓+2NaCl 除去氯化钙和过量的氯化钡 BaCl2 除去滤液中过量的氢氧化钠和碳酸钠 HCl+NaOH=NaCl+H2O
【解析】
(1)过滤能将反应生成的沉淀和溶液分离,故填过滤;
(2)加入过量氯化钡能使溶液中的硫酸根离子反应完全,氯化钡和硫酸钠反应生成氯化钠和硫酸钡沉淀,故填BaCl2+Na2SO4=BaSO4↓+2NaCl;
(3)加入碳酸钠溶液可以除去氯化钙和过量的氯化钡,故填除去氯化钙和过量的氯化钡;碳酸钠和氯化钡顺序颠倒时,过量的氯化钡无法除去,最后所得的精盐水中会含有氯化钡,故填BaCl2;
(4)向滤液中滴加适量稀盐酸时,稀盐酸能和过量的氢氧化钠、碳酸钠反应,从而除去氢氧化钠和碳酸钠,故填除去滤液中过量的氢氧化钠和碳酸钠;稀盐酸和氢氧化钠反应的方程式为HCl+NaOH=NaCl+H2O,稀盐酸和碳酸钠反应的化学方程式为Na2CO3+2HCl=2NaCl+H2O+CO2↑,任意一个都可以,故填HCl+NaOH=NaCl+H2O。
-
科目: 来源: 题型:
查看答案和解析>>【题目】根据如表回答问题
温度(℃)
20
40
50
60
80
溶解度
(g/100g水)
NaCl
36.0
36.6
37.0
37.3
38.4
NH4Cl
37.2
45.8
50.4
55.2
65.6
KNO3
31.6
63.9
85.5
110
169
(1)40℃时,100g水中最多溶解NaCl______ g
(2)A是80℃含有120g水的KNO3溶液,经过如下操作,A经恒温蒸发得到B,B经降温至200C得到C,过滤后得到102gKNO3固体。流程如下图所示。
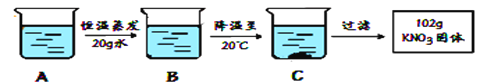
①A溶液为________(选填“饱和”或“不饱和”)溶液
②对以下过程的分析,正确的是_________(选填编号)
a.A到B的过程中,溶质质量没有改变 b.B中溶质与溶剂的质量比为169:100
c.A溶液的质量等于222g d.开始析出KNO3固体的温度在60℃至80℃之间
-
科目: 来源: 题型:
查看答案和解析>>【题目】观察与比较是化学学习和研究中经常使用的方法。请结合下列实验,回答问题:
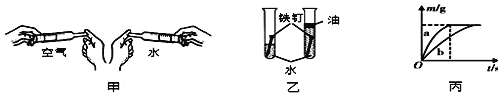
(1)甲图实验中,装_______(填“空气”或“水”)的注射器内的物质更容易被压缩。
(2)乙图实验的目的是探究铁生锈时是否需要_______。(填“氧气”或“氧气和水”)
(3)取一定质量的镁、铁两种金属,分别与相同浓度的稀盐酸反应,产生氢气的质量(m)与反应时间(t)的关系如丙图所示。图中_______(选填“a”或“b”)曲线表示镁的反应。根据丙图,还可推知反应结束时,镁、铁所消耗的稀盐酸的质量比为_______。
-
科目: 来源: 题型:
查看答案和解析>>【题目】初中化学几种常见物质间的转化关系如图所示。其中A是人体胃液中含有的成分,B可用于改良酸性土壤,G是铁锈的主要成分(Fe2O3·xH2O),E、F、I均为无色气体。请回答下列问题。
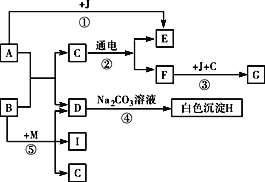
(1)写出有关物质的化学式:A _______,D_______,J_______,H________。
(2)写出有关反应的化学方程式:
反应:__________;
反应⑤:__________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】根据下图回答相关问题:
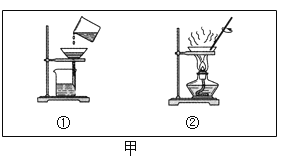
(1)图甲是“粗盐中不溶性杂质除去”实验时其中的二个操作,操作①中缺少的是_______(填一仪器的名称),操作②时当观察到_____时就停止加热。
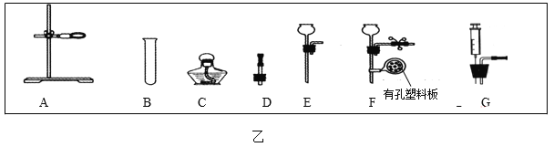
(2)选择图乙A~G完成下列实验:
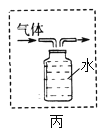
①用氯酸钾和二氧化锰混合加热来制取氧气,发生装置应选用的仪器有_____(选填序号),发生反应的化学方程式是_______。若用图丙来收集产生的氧气,请将丙图补画完整_____。
②实验室制取CO2时,其反应的化学方程式是____。 若选择ABG组装成一套气体发生装置,优点是____,选择AB和____(选填序号字母)能够组装成一个可随时使反应停止和发生的气体发生装置。
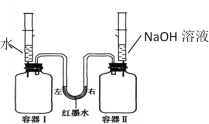
(3)如图装置中容器Ⅰ、Ⅱ都盛等体积CO2,分别用注射器向两个容器中注入等量的水和NaOH溶液,观察到____现象,说明CO2能与NaOH溶液发生反应。
-
科目: 来源: 题型:
查看答案和解析>>【题目】α-丙氨酸是合成蛋白质的基础物质之一,其分子结构如图所示(注“-”表示原子之间相互连接)。
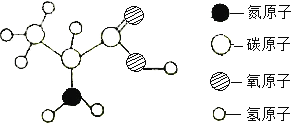
(1) α-丙氨酸的相对分子质量为____;α-丙氨酸中碳原子、氢原子、氧原子的原子个数比为____;
(2) α-丙氨酸中碳元素、氢元素、氧元素的质量比为_____;
(3)17.8gα-丙氨酸中含氮元素的质量为_____。
-
科目: 来源: 题型:
查看答案和解析>>【题目】碳元素是组成许多物质的基本元素,回答下列含碳元素的有关问题,
(1)倡导”低碳”生活,主要为了减少_____________的排放量;
(2)金刚石和石墨的物理性质差异较大,主要原因是________________;
(3)为减少温室气体CO2的排放,科学家将CO2和H2在催化剂和加热条件下反应,转化为水和甲烷(CH4),该反应的化学方程式为___________。
相关试题

