【题目】课外探究小组为了测定氯化钠和氯化钙的干燥固体混合物中氯化钠的质量分数并提纯氯化钠,设计了以下实验方案:
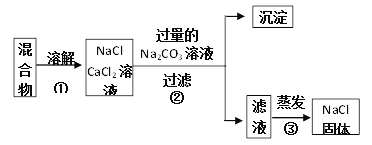
试回答下列问题:
(1)沉淀是______________填化学式)。
(2)未经干燥就称量实验所得的固体(沉淀),则氯化钠的质量分数____________(填“不变”、“偏大”或“偏小”)。
(3)请说明此设计方案是否严谨的理由:___________________________
参考答案:
【答案】 CaCO3 偏小 此方案不严谨,过量的Na2CO3没有除掉,混入了NaCl固体中
【解析】
(1)氯化钙和碳酸钠生成碳酸钙和氯化钠,碳酸钙是沉淀,化学式为:CaCO3;(2)混合物中某种物质的质量分数=![]() ×100%,根据题目的信息可知,碳酸钠和氯化钙生成碳酸钙和氯化钠,由沉淀的质量可以计算出氯化钙的质量;根据某种物质的质量分数的计算公式可知,要想计算出氯化钠的质量分数,就需要称量混合物的质量;氯化钠的质量等于混合物的质量-氯化钙的质量,所以未经干燥就称量实验所得的固体(沉淀),则氯化钠的质量分数偏小;(3)由于碳酸钠过量,所以滤液中的物质有氯化钠和碳酸钠,因此要得到纯净的氯化钠就需要除去碳酸钠,所以此方案不严谨。
×100%,根据题目的信息可知,碳酸钠和氯化钙生成碳酸钙和氯化钠,由沉淀的质量可以计算出氯化钙的质量;根据某种物质的质量分数的计算公式可知,要想计算出氯化钠的质量分数,就需要称量混合物的质量;氯化钠的质量等于混合物的质量-氯化钙的质量,所以未经干燥就称量实验所得的固体(沉淀),则氯化钠的质量分数偏小;(3)由于碳酸钠过量,所以滤液中的物质有氯化钠和碳酸钠,因此要得到纯净的氯化钠就需要除去碳酸钠,所以此方案不严谨。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某无色气体可能含有H2、CO、CH4中的一种或几种,依次进行下列实验(假设每一步反应或吸收均完全):①无色气体在氧气中充分燃烧;②燃烧后生成的气体通过盛浓硫酸的装置,装置的质量增加12.6g;③再将剩余气体通过盛NaOH溶液的装置,装置的质量增加13.2g。下列推断正确的是
A. 该气体不可能只含H2和CO B. 该气体可能只含H2和CH4
C. 该气体可能只含CO和CH4 D. 该气体可能只含CH4
-
科目: 来源: 题型:
查看答案和解析>>【题目】将C2H5OH和O2置于密闭容器中,点燃使其恰好完全反应,产物为CO、CO2和H2O,待容器恢复至室温,测得容器内CO和CO2的混合气体中碳元素的质量分数为36%,则该反应的化学方程式为_________
-
科目: 来源: 题型:
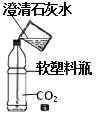
查看答案和解析>>【题目】如图所示,将一定量的澄清石灰水快速倒入盛满CO2的软塑料瓶中并盖紧瓶盖,振荡,你看到的现象是________________________________________________。请你设计实验证明,塑料瓶内剩余气体是否还有CO2?(任选仪器和药品)____________________
-
科目: 来源: 题型:
查看答案和解析>>【题目】请你和同学们一起探究:
(提出问题)甲烷燃烧后生成哪些物质?
(查阅资料)含碳元素的物质完全燃烧生成CO2,不完全燃烧生成CO;无水CuSO4遇水变蓝。
(猜想)甲同学:CO2、H2O;乙同学:CO、H2O;丙同学:NH3、CO2、H2O;丁同学:CO2、CO、H2O
(实验探究)为了验证上述猜想,将甲烷在一定量的纯净氧气中燃烧的产物依次通过下列装置,进行验证:
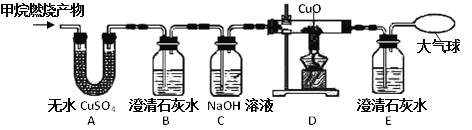
请你回答下列问题:
(1)哪位同学的“猜想”不合理并说明理由:_______________________。
(2)A、B装置的顺序能否颠倒?原因是_____________________。
(3)实验中用纯净O2而不用空气的原因是__________________。
(4)实验中观察到A中________________,B、E中澄清石灰水变浑浊,D中黑色粉末变红,由此推断________同学猜想成立。
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图是实验室常用的仪器,请用图中仪器的名称按要求填空:

(1)用于夹持试管的仪器是 ;
(2)取用粉末状药品时一般选用 ;
(3)用于吸取和滴加少量液体的是 ;
(4)常用于给物质加热的仪器是 ;
(5)既可用作反应容器又能直接受热的是 ;
(6)用来收集和贮存少量气体时需用 .
-
科目: 来源: 题型:
查看答案和解析>>【题目】图中A、B、C、D是四种粒子的结构示意图,请回答下列问题:

(1)图中A、B、C、D粒子共表示_____种元素。
(2)A、B、C、D中的阳离子与阴离子所形成的化合物的化学式为_____。
(3)晶体硅是制造半导体芯片的原料,如图是硅原子的结构示意图,图中
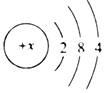 x的值是_____。
x的值是_____。(4)硅元素的化学性质与A、B、C、D中_____(填字母序号)对应的元素的化学性质相似。
相关试题

