【题目】如图是某胃药标签的部分内容。晓彤同学测定该药品中NaHCO3含量的过程如下:取10粒该药剂研碎后放入烧杯中,加入50g水后充分搅拌,再向其中滴加稀盐酸至溶液的pH=7时(已知药品中的其它成分既不溶于水,也不与稀盐酸反应),形成NaCl的不饱和溶液,共消耗稀盐酸11.5g,称得反应后烧杯内物质的总质量为64.3g。

请计算:
(1)胃药中NaHCO3的质量分数。
(2)反应后所得溶液中溶质的质量分数(计算结果精确到0.1%)。
参考答案:
【答案】(1)84%;(2)4.6%
【解析】根据质量守恒定律可得,生成的二氧化碳质量为10×0.5g+50g+11.5g-64.3g=2.2g
设胃药中碳酸氢钠的质量为x,生成的氯化钠的质量为y,
NaHCO3+HCl═NaCl+H2O+CO2↑
84 58.5 44
x y 2.2g
![]()
x=4.2g,y=2.925g
胃药中NaHCO3的质量分数为: ![]() ×100%=84%
×100%=84%
反应后溶液中NaCl的质量分数为![]() ×100%≈4.6%
×100%≈4.6%
答:(1)胃药中NaHCO3的质量分数为84%。
(2)反应后所得溶液中溶质的质量分数约为4.6%。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列食物中,富含维生素的是( )
A. 鸡蛋 B. 牛奶 C. 苹果 D. 大豆
-
科目: 来源: 题型:
查看答案和解析>>【题目】用下列化学用语填空:
稀释 乳化 过滤 氧化 蒸馏 溶解 吸附
(1)降低水硬度的方法 ;
(2)除去河水中泥沙的方法 ;
(3)用活性炭除去毒气 ;
(4)将溶液溶质质量分数变小 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某化学课堂围绕“酸碱中和反应”,将学生分成若干小组,在老师引导下开展探究活动。以下是教学片段,请你参与学习并帮助填写空格(包括表中空格)。
【演示实验】将一定量的稀H2SO4加入到盛有NaOH溶液的小烧杯中。
【学生板演】该反应的化学方程式______________________。
【提出问题】实验中未观察到明显现象,某同学提出疑问:反应后溶液中溶质是什么?
【假设猜想】针对疑问,大家纷纷提出猜想。甲组同学的猜想如下,请你补上猜想四。
猜想一:只有Na2SO4 猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4、H2SO4和NaOH 猜想四:________________。
乙组同学认为有一种猜想是不合理的。不合理的猜想是_______,理由是____________。
【实验探究】(1)丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有___________________。
(2)为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用了老师提供的pH试纸、Na2CO3溶液、BaC12溶液,进行如下三个方案的探究。
实验方案
测溶液的pH
滴加Na2CO3溶液
滴加BaCl2溶液
实验操作



实验现象
试纸变色,对比比色卡,pH<7
______________
产生白色沉淀
实验结论
溶液中有H2SO4
溶液中有H2SO4
溶液中有H2SO4
【得出结论】通过探究,全班同学一致确定猜想二是正确的。
【评价反思】老师对同学们能用多种方法进行探究,并且得出正确结论给予肯定,同时指出【实验探究】(2)中存在两处明显错误。同学们经过反思发现了如下两处错误:
(1)实验操作中的错误是_____________________________;
(2)实验方案中也有一个是错误的,错误的原因是____________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】A~J分别是初中化学中常见的物质,它们存在如下转化关系。其中B、D、F、J在常温下均为无色气体且J能使湿润的红色石蕊试纸变蓝,A为红棕色固体,E在常温下为无色液体,H的溶液呈蓝色。(反应中的个别生成物已略去)

(1)I的化学式为___________,J的水溶液中的阴离子符号为________。
(2)写出化学方程式:反应①__________________;反应④__________________。
(3)在反应①~⑤中没有涉及的基本反应类型是_________反应。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列物质中,属于混合物的是( )
A. 矿泉水 B. 冰水混合物 C. 高锰酸钾 D. 氢氧化钙
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列实验操作符合安全要求的是( )
A.
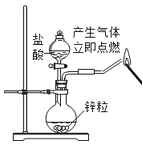 验证氢气的可燃性 B.
验证氢气的可燃性 B. 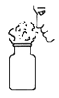 闻气体气味
闻气体气味C.
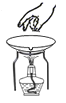 移走蒸发皿 D.
移走蒸发皿 D.  稀释浓硫酸
稀释浓硫酸
相关试题

