【题目】人体缺乏维生素C可能引发多种疾病,某研究性学习小组对它研究如下。
(1)假设:维生素C可能具有酸性。
(2)实验方案:提供的试剂有维生素C片、蒸馏水、紫色石蕊试液、无色酚酞试液、氢氧化钠溶液、pH试纸。根据以上试剂,请你设计出两种实验方案,并写出实验现象。___________________________
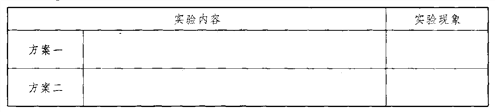
(3)结论:维生素C具有酸性。
(4)维生素C在酸性环境下比较稳定,在高温时易被破坏。请你想想,如何食用黄瓜才能充分利用其中丰富的维生素C?________________________。
参考答案:
【答案】 方案一:将维生素C片溶于蒸馏水,滴加紫色石蕊试液石蕊由紫色变为红色 方案二:将维生素C片溶于蒸馏水,用pH试纸测定该溶液的pH pH<7(合理答案均可) 直接生吃或加醋凉拌后生吃(合理答案均可)
【解析】(1)紫色石蕊试液遇到酸变为红色,故可以设置以下方案;方案一:将维生素C片溶于蒸馏水,滴加紫色石蕊试液石蕊由紫色变为红色 方案二:将维生素C片溶于蒸馏水,用pH试纸测定该溶液的pH pH<7;(2)为了防止高温破坏维生素,可以直接生吃或加醋凉拌后生吃。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列自然资源的利用过程中,一定发生了化学变化的是( )
A.水力发电 B.将石油加热炼制,得到不同的产品
C.海水晒盐 D.利用铁矿石炼铁
-
科目: 来源: 题型:
查看答案和解析>>【题目】科学家预言未来最理想的能源是绿色植物,即将绿色植物的秸秆[主要成分的化学式为(C6H10O5)n]和水在适当的催化剂等条件作用下生成葡萄糖(化学式为C6H12O6),再将葡萄糖在一定条件下转化为乙醇(化学式为C2H5OH,是一种良好的燃料),同时放出二氧化碳。试写出上述两步转化的化学方程式:
(1)_________________________________________________。
(2)_________________________________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】泰安的豆腐闻名遐迩。豆腐制作是中国古代的一项重要发明,现在豆腐在全球已成为颇受欢迎的食品,其制作的主要工艺流程通常如下:

【资料】下表是豆腐中主要成分的平均质量分数:

请回答以下问题:
(1)上述工艺流程中,磨浆属于_______(填“物理”或“化学”)变化,由豆腐花制豆腐的过程就是将豆腐与水分离,该过程利用的操作名称是_______。
(2)除水、无机盐和维生素外,豆腐中还含的营养素有_____________________,含人体所需的微量元素是_______。
-
科目: 来源: 题型:
查看答案和解析>>【题目】宏观与微观相联系是化学最特征的思维方式。下列对宏观现象的微观解释错误的是( )
A.温度计受热时水银柱上升,是因为汞原子受热时体积变大
B.稀盐酸和稀硫酸都能使紫色石蕊试液变红,是因为它们溶液中的阳离子都是H+
C.20mL酒精和20mL水混合后体积小于40mL,是因为分子之间存在间隔
D.缉毒犬能根据气味发现毒品,是因为分子在不断地运动
-
科目: 来源: 题型:
查看答案和解析>>【题目】某化学研究性学习小组为测定市场出售的食醋的总酸量(国家规定食醋中总酸量为3.5 g/100 mL~5 g/100 mL),拟配制一定质量分数的氢氧化钠溶液,然后进行测定。
请你参与该小组的实验研究,并回答相关问题。
(1)配制100 g质量分数为5%的氢氧化钠溶液,需要水多少mL。(水的密度为1 g/cm3)
(2)若食醋中的酸均看成是醋酸,醋酸与氢氧化钠反应的化学方程式为CH3COOH+NaOH=CH3COONa+H2O。现有食醋500 mL,甲同学从中取出10 mL,加入5%的氢氧化钠溶液4.8 g,恰好完全反应。请通过计算判断该食醋是否合格。(写出计算过程)
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列混合物可用过滤方法分离的是( )
A. 酒精和水 B. 食盐和泥沙 C. 矿泉水和可乐 D. 铁粉和铜粉
相关试题

