【题目】“过碳酸钠”(2Na2CO3·3H2O2)俗称固体双氧水,它既有碳酸盐的性质,又有双氧水的不稳定性和氧化性,是很好的消毒剂和供氧剂,广泛应用于洗涤、印染和医药等领域。“过碳酸钠”的制备流程如下:
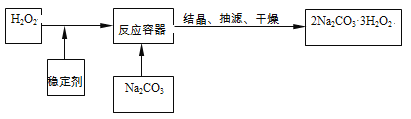
请回答下列问题:
⑴H2O2在催化或受热条件下易分解,其化学方程式为______________________;在上述流程中,向反应前的H2O2中加入稳定剂的作用是______________________。
⑵在“过碳酸钠”中加入下列物质时,不会导致“过碳酸钠”变质的是_______(填序号)。
A.二氧化锰 B.稀盐酸 C.硫酸钠 D.石灰水
⑶“过碳酸钠”极易分解,得到碳酸钠、水和氧气,其反应方程式可表示为
2(2Na2CO3·3H2O2)![]() 4Na2CO3+6H2O+3O2↑
4Na2CO3+6H2O+3O2↑
请通过计算说明:①若“过碳酸钠”分解产生氧气12g,则同时产生碳酸钠的质量是____?
②若将上述产生的碳酸钠全部配制成溶质质量分数为10.6%的溶液,需加水的质量是________?
参考答案:
【答案】 2H2O2![]() 2H2O+O2↑ 防止双氧水分解 C 生成Na2CO3的质量为53g 配成10.6%的溶液需加水的质量为447g
2H2O+O2↑ 防止双氧水分解 C 生成Na2CO3的质量为53g 配成10.6%的溶液需加水的质量为447g
【解析】本题是信息题,主要考查了碳酸钠与过氧化氢的性质和根据化学方程式的综合计算。
(1)双氧水在二氧化锰作用下分解生成水和氧气,化学方程式为:2H2O2![]() 2H2O+O2↑;双氧水在常温下就能分解,所以在反应前加入稳定剂的作用是防止双氧水分解.
2H2O+O2↑;双氧水在常温下就能分解,所以在反应前加入稳定剂的作用是防止双氧水分解.
(2)“过碳酸钠”(2Na2CO3·3H2O2)俗称固体双氧水,它既有碳酸盐的性质,又有双氧水的不稳定性和氧化性,导致碳酸钠变质的原因是与碳酸钠或双氧水反应了,
A、加入二氧化锰,使双氧水分解而变质;
B、加入稀盐酸,与碳酸钠反应而变质;
C、加入硫酸钠,不能与碳酸钠和双氧水反应,不变质;
D、加入石灰水,与碳酸钠反应生成碳酸钙和氢氧化钠而变质。故选C。
(3)①设:生成Na2CO3的质量为x
2(2Na2CO33H2O2)═4Na2CO3+6H2O+3O2↑
424 96
x 12g
![]() =
=![]()
x=53g
②设将这些碳酸钠粉末配成溶质质量分数为10.6%的溶液需加水的质量为y
![]() =500g
=500g
500g﹣53g=447g
或
![]() ×100%=10.6%,y=447g
×100%=10.6%,y=447g
答:生成Na2CO3的质量为53g,配成10.6%的溶液需加水的质量为447g.
-
科目: 来源: 题型:
查看答案和解析>>【题目】某化工厂排放的废液中含有大量的硫酸锌和硫酸铜,化学兴趣小组的同学根据所学知识设计了一个方案,用来回收金属铜并得到硫酸锌晶体,主要过程如下图所示:
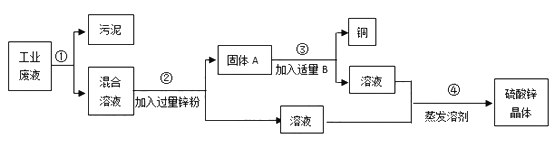
请回答下列问题:
(1)步骤②中分离物质的方法是_________。
(2)固体A的成分是_________。
(3)步骤②中发生反应的化学方程式为__________________,
(4)步骤③中加入的B物质是____________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】溶解度可表示物质溶解性的大小。
①左下图是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线。
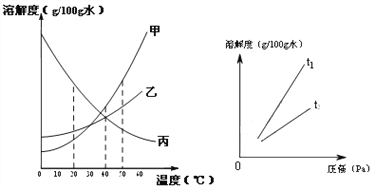
Ⅰ.20℃时,甲的溶解度________(填“>”、“<”或“=”)乙的溶解度。
Ⅱ.40℃时,乙和丙________(填“能”或“不能”)形成溶质质量分数相同的饱和溶液。
Ⅲ.20℃时,烧杯中分别盛有相同质量甲、乙、丙的饱和溶液,各加入等质量的对应固体,并升温至50℃。请填写下表。
烧杯中的溶质
烧杯中固体的变化
甲
__________________
乙
固体逐渐减少至全部溶解
丙
__________________
②气体的溶解度也有一定的变化规律。
Ⅰ.打开可乐瓶,逸出大量气泡。由此可见,压强越小,CO2的溶解度越_________。为增大CO2的溶解度,可采用的一种方法是________。
Ⅱ.不同温度下,氧气的溶解度随压强的变化如右图所示,图中t1对应的温度为40℃,则t2对应的温度________(填编号)。
a.大于40℃ b.小于40℃ c.无法确定
-
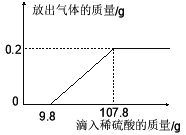
科目: 来源: 题型:
查看答案和解析>>【题目】在烧杯中加入2.14g久置的铝箔,再滴加稀硫酸,放出气体的质量与所加稀硫酸质量的关系如右图所示。请回答下列问题:
(1)产生氢气 g,刚开始滴加稀硫酸没有氢气放出的原因是 。
(2)所滴加的稀硫酸中溶质的质量分数。
(3)铝箔中铝元素的质量。
-
科目: 来源: 题型:
查看答案和解析>>【题目】镍在元素周期表中的信息如下图所示,下列有关镍元素的说法不正确的是
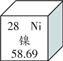
A. 原子序数是28 B. 属于金属元素
C. 原子中的质子数是28 D. 相对原子质量为58.69 g
-
科目: 来源: 题型:
查看答案和解析>>【题目】A、B两图分别表示硫、铁丝在氧气中燃烧的示意图。
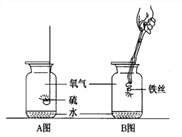
请填空:
(1)A图中水的作用是____________________________;
B图中水的作用是 ___________________________;
(2)铁丝在氧气中燃烧的现象是剧烈燃烧,火星四射,________________,放出大量热,该反应的化学方程式是_________________________ 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】阅读下面科普短文(原文作者:杨骏等,有删改)
即使艳阳高照、天气晴好,有时人们也会出现眼睛刺痛、咳嗽等不良症状。专家认为,这很可能与臭氧(O3)有关。
臭氧原本是大气中自然产生的一种具有特殊臭味的微量气体。绝大部分臭氧存在于离地面25公里左右处的大气平流层中,这就是人们通常所说的臭氧层。臭氧量往往随纬度、季节和天气等因素的变化而不同。研究人员发现,天空中的臭氧层能吸收99%以上的太阳紫外线,为地球上的生物提供了天然的保护屏障。为何它又成了危害健康的污染物?
地表臭氧并非自然产生的,而是由石油产品(如汽油)等矿物燃料燃烧产生的氮氧化物(如二氧化氮)与空气中的氧气结合而形成的。强烈的阳光照射会加速这一化学反应。
地表空气中的臭氧对人体极为有害,一些易于过敏的人长时间暴露在臭氧含量超过每立方米180微克的环境中,会产生上述不良症状。研究表明,空气中每立方米臭氧含量增加100微克,人的呼吸功能就会减弱3%。对于运动员来说,空气中的臭氧含量可以直接影响到他们的耐力和比赛成绩。
自2013年中国执行新《环境空气质量标准》,监测6种污染物以来,臭氧便成为一些城市夏季空气质量“超标日”的首要污染物。下图为某地夏季某日昼时(7:00~18:00)臭氧、二氧化氮(NO2)浓度随时间的变化图。
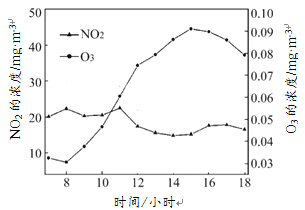
依据文章内容回答下列问题。
(1)请在方框中用图示表示1个臭氧分子的微观构成。

(2)地表空气中的臭氧是由 (填物质名称)直接转化生成的。
(3)如上图,某地夏季某日昼时,臭氧污染最严重的时间段是 (填序号)。
A.8:00~10:00 B.10:00~12:00 C.12:00~14:00 D.14:00~16:00
(4)下列说法正确的是 (填序号)。
A.臭氧是一种无色无味气体
B.臭氧层具有吸收紫外线的作用
C.地表空气中臭氧的含量与天气阴晴无关
D.空气中臭氧浓度不同会对人体造成不同程度的影响
(5)为了减少臭氧污染,请你向市民提出一条生活中可行的倡议 。
相关试题

