【题目】水和溶液在生命活动和生产、生活中起着十分重要的作用。
①某净水过程:天然水![]() 沉降→过滤→吸附
沉降→过滤→吸附![]() 净水,向水中加入活性炭是利用其 性除去水中的杂质;工业上制取消毒剂X的化学方程式:Cl2+2NaClO2→2NaCl+2X,则X的化学式为 。
净水,向水中加入活性炭是利用其 性除去水中的杂质;工业上制取消毒剂X的化学方程式:Cl2+2NaClO2→2NaCl+2X,则X的化学式为 。

②右图是电解水的实验装置图,此实验过程中电极上出现的现象是 ,写出反应的化学方程式 。
③20℃时,等质量的甲、乙固体(不含结晶水),分别加入到盛有100g水的烧杯中,充分搅拌后现象如图1,加热到50℃时现象如图2(不考虑水分蒸发),甲、乙物质的溶解度曲线如图3。

Ⅰ.图3中,表示甲的溶解度曲线是 (填“M”或“N”)。
Ⅱ.P点表示的意义是 。
Ⅲ.50℃时,80克乙物质中加入120g水后所得溶液的溶质的质量分数是 。
Ⅳ.50℃时,甲乙两种等质量的饱和溶液,降温至20℃时,溶液中的溶剂m甲 m乙(填“>;<;=”)
Ⅴ.在图1到图2的变化过程中,如不借助图3的信息,只能得出的结论是 。
A.图2中乙溶液一定不饱和
B.图2中两溶液中溶质质量分数一定相等
C.该实验能证明甲物质的溶解度受温度影响大
D.图2中乙溶液降温至30℃无晶体析出
参考答案:
【答案】①吸附 ClO2 ②产生气泡 2H2O通电2H2↑+O2 ↑
③Ⅰ.M Ⅱ.30℃甲乙两种物质溶解度相同
Ⅲ.9/39或23.1%或3/13 Ⅳ.< Ⅴ.B、D
【解析】
试题分析:①活性炭具有吸附性,向水中加入活性炭是利用其吸附性除去水中的杂质;根据质量守恒定律的微观解释:在化学反应前后,原子的种类、数目都不变,结合化学反应:Cl2+2NaClO2→2NaCl+2X,可以推出X化学式为ClO2
②电解水的实验过程中电极上出现的现象是:产生气泡;电解过程中生成氢气和氧气,故反应的化学方程式为:2H2O通电2H2↑+O2 ↑
③Ⅰ.20℃时,等质量的甲、乙固体(不含结晶水),分别加入到盛有100g水的烧杯中,充分搅拌后现象如图1,甲有溶质没有溶解,说明20℃时,甲的溶解度比乙的溶解度要更小,故通过溶解度曲线,可判断图3中,表示甲的溶解度曲线是M
Ⅱ.P点表示的意义是:30℃甲乙两种物质溶解度相同
Ⅲ.根据溶解度曲线,50℃时,乙物质的溶解度为30g,表示在50℃时,在100g水中达到饱和状态最多能溶解乙物质的质量为30g,故80克乙物质中加入120g水后所得溶液为饱和溶液,故此时溶质的质量分数是:9/39或23.1%或3/13
Ⅳ.根据溶解度曲线图,50℃时,可看出甲物质的溶解度>乙物质的溶解度,故50℃时,甲乙两种等质量的饱和溶液中溶液中的溶剂m甲< m乙,而在降温至20℃的过程中,只是溶质结晶析出,溶液中的溶剂质量不变,故溶液中的溶剂m甲< m乙
Ⅴ.A、因为并不知道,乙物质的溶解度随温度的变化趋势,故在由20℃升温至50℃时,图2中乙溶液不一定饱和,也有可能刚好饱和,错误,B、因为根据图示,图2中的溶质都全部溶解,故此时两溶液中溶质质量分数一定相等,正确,C、该实验只能证明甲物质的溶解度随温度升高而增大,并不能说明甲物质的溶解度受温度影响大,错误,D、,根据乙物质,在20℃、50℃时,溶液中都没有溶质析出,故图2中乙溶液降温至30℃无晶体析出,正确,故选B、D
-
科目: 来源: 题型:
查看答案和解析>>【题目】成语是我国的文化瑰宝,请用恰当的化学用语表示下列成语相关内容中带点的字:
(1)如胶似漆:胶中含有碳、氢、钙等元素,写出其中一种非金属的元素符号 ;
(2)争风吃醋:醋酸溶液中含有氢离子 ;
(3)信口雌黄:雌黄即三硫化二砷(砷元素符号As),三硫化二砷的化学式 ;
-
科目: 来源: 题型:
查看答案和解析>>【题目】根据如图所示的实验装置图回答:

写出图中标号仪器的名称:a 。
实验室用双氧水制取氧气应选用的装置是 (填序号),写出反应的化学方程式 。装置C中的注射器其作用与装置B中长颈漏斗不同之处是 。装置D可用于向上排气法收集氧气,气体应从 导气管口进入。
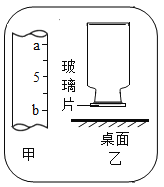
用E装置做硫在氧气中燃烧实验,用10mL量筒量取6mL水,读数时量筒内的液体凹液面最低处应于甲图中 处(填“a”或“b”)刻度线保持水平。燃烧结束后取出燃烧匙,立即用玻璃片盖住瓶口并振荡,若将集气瓶倒转,发现玻璃片被“吸住”而掉不下来(如乙图),其原因是 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】氮元素与硫元素的本质区别是
A.质子数不同 B.电子数不同
C.中子数不同 D.最外层电子数不同
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列物质在氧气中燃烧,火星四射、生成黑色固体的是
A.木炭 B.铁丝 C.蜡烛 D.红磷
-
科目: 来源: 题型:
查看答案和解析>>【题目】在宏观、微观、符号之间建立联系,是化学学科特有的思维方式。
①氦气、水、干冰三种物质中由原子直接构成的物质是 (填化学式)。
②某种催化剂可以把汽车尾气中的一氧化碳、二氧化氮转化为两种空气的无毒成分(下图是该反应的部分微观示意图)
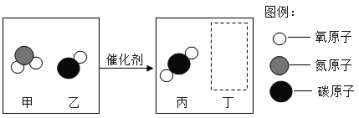
写出该反应的化学方程式 ,反应过程中元素的存在形态发生变化的是 (填元素符号)。生成物的分子个数比与 (填“质量”或“物质的量”)之比相等,在该反应中作还原剂的物质是 。
③科学家屠呦呦因创制新型抗疟疾——青蒿素(化学式是C15H22O5)和双氢青蒿素(化学式是C15H24O5)的贡献,获得2015年度诺贝尔奖。该两种物质都是由 种元素组成的,每摩尔分子都约含有 个氧原子。等物质的量的这两种物质中氢元素的质量比 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】2015年3月22日是第22届“世界水日”。联合国确定今年“世界水日”的宣传主题是“水与能源”。下列说法正确的是
A.用明矾可以区别硬水和软水
B.为了防止水体污染,禁止使用农药和化肥
C.氢氧燃料电池可以将化学能直接转化为电能
D.石油经分馏或其他加工方法可以得到汽油、煤油等,这个过程是化学变化
相关试题

