【题目】(10分)纳米碳酸钙是一种重要的化工产品,下图是某厂生产纳米碳酸钙的工艺流程。

请回答下列问题:
(1)请完成该工艺中生成CaCO3固体的反应方程式:
CaCl2 + 2NH3·H2O + CO2 = CaCO3↓ + 2NH4Cl + _________
(2)若在实验室中进行该实验,操作l的名称是_______,所需要的仪器有________(填字母序号),其中玻璃棒的作用是____________。
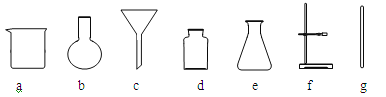
(3)操作2为洗涤、干燥,其中洗涤的目的是除去碳酸钙粗品表面含有的可溶性杂质,其中一定含有的可溶性杂质是______________,检验是否洗涤干净的方法是向最后一次洗涤液中加入______溶液(①Ca(OH)2、②AgNO3 、③CaCl2,填写序号),如果没有出现沉淀,说明已经洗涤干净。
(4)上述流程中的副产品(NH4Cl)可用作________(写一种用途)。NH4Cl与NaOH溶液混合微热,产生的气体能使湿润的红色石蕊试纸变 色.施用该肥料时,要避免与______(填“酸性”或“碱性”)物质混合使用,以免 。
参考答案:
【答案】(1)H2O;(2)过滤;acfg;;引流;(3)NH4Cl;②;(4)氮肥(合理即可);蓝;碱性;降低肥效。
【解析】
试题分析:(1)由质量守恒定律可知,反应前后原子种类和个数不变,那么该物质是由2H和O构成的分子即H2O;(2)分离固体和液体用过滤;(3)根据反应方程式可知CaCl2和2NH3·H2O是反应物可能有剩余也可能完全消耗,而NH4Cl是生成物一定含有;若洗涤干净那就肯定不含有NH4Cl,即可以通过测其的存在来判定是否洗涤干净,NH4Cl和Ca(OH)2有NH3(刺激性气味的气体)生成,NH4Cl和AgNO3有AgCl(白色沉淀)生成,都可以判定NH4Cl的存在;(4)含有N且能溶于水,可以作为氮肥;该气体为NH3,和溶液中的水生成NH3·H2O是碱性,石蕊变蓝;由上NH4Cl 会和碱性物质反应生成NH3,从而降低肥效。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图是甲、乙、丙三种物质的溶解度曲线。下列说法错误的是
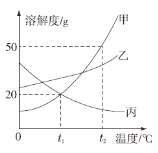
A、要配制相同质量分数的甲、丙两种物质的饱和溶液,应该将温度控制在t1 ℃
B、t2 ℃时,将30 g甲物质加入到50 g水中不断搅拌,形成的溶液的质量是80g
C、要从甲物质的饱和溶液中获得晶体甲,可采用降温结晶的方法
D、将丙物质的饱和溶液转化为不饱和溶液可以采用加水或降温的方法
-
科目: 来源: 题型:
查看答案和解析>>【题目】按要求填空:
(1)用化学符号填空: 3个硫原子 ;1个钠离子 ;
(2)用化学式填空:硫酸 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验是学习化学的一个重要途径。
(1)根据下图回答问题。
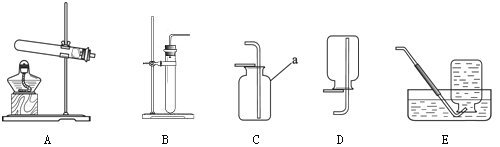
①仪器a的名称是 。
②实验室用高锰酸钾制取氧气时,所选用的发生装置是 (填字母序号,下同),收集装置
是 或E。写出该反应的化学方程式 。
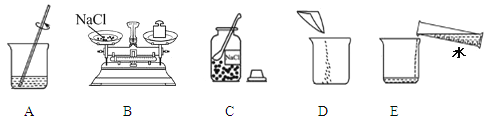
(2)实验室配制50g 5%的氯化钠溶液的操作示意图如图所示。其中玻璃棒的作用是 。该实验的正确操作顺序为 (填字母序号)。
(3)实验室常用过氧化氢溶液与二氧化锰混合制取氧气.现将2.5g二氧化锰放入盛有100g过氧化氢溶液的锥形瓶中,反应完全结束后,共收集到1.6g气体.请完成下列问题:
①反应结束后,过滤,洗涤并烘干滤渣,称得滤渣的质量为 g.
②计算原过氧化氢溶液中溶质的质量分数.
-
科目: 来源: 题型:
查看答案和解析>>【题目】甲、乙、丙三个集气瓶中,分别盛有空气、氮气和氧气,用一根燃着的木条分别插入瓶中,依次观察到火焰熄灭、继续燃烧、燃烧更旺,瓶中所盛气体分别是( )
A.氧气、氮气、空气 B.氮气、氧气、空气
C.空气、氧气、氮气 D.氮气、空气、氧气
-
科目: 来源: 题型:
查看答案和解析>>【题目】今年冰岛火山喷发对欧洲多国造成了严重的环境污染。下列物质中不属于空气污染物的是
A.氧气 B.二氧化硫 C.火山灰 D.一氧化碳
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图是KNO3和NH4Cl的溶解度曲线,下列说法正确的是
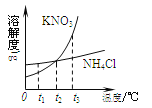
A.KNO3的溶解度大于NH4Cl
B.NH4Cl的溶解度受温度的影响大于KNO3
C.t1℃时,饱和NH4Cl溶液升温到t2℃时变成不饱和溶液
D.t 3℃时,饱和KNO3溶液降温到t2℃时变成不饱和溶液
相关试题

