【题目】烟台有漫长的海岸线,蕴藏着丰富的海洋资源。
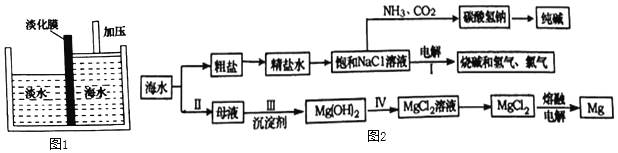
(1)海水淡化。可以采用如图1所示的膜分离法淡化海水,水分子可以通过淡化膜(海水中体积较大的盐的离子和其他分子不能通过)进入左侧的淡水池,从而得到淡水。下列说法中正确的是________(填字母序号)。
A 膜分离法的原理与滤纸过滤原理类似
B 膜分离法还可以浓缩海水中的盐类物质
C 膜分离法也是一种分离混合物的方法
D 该膜分离法的目的是除去海水中的不溶物
(2)粗盐提纯。除去难溶性杂质后的食盐水中还含有Ca2+、Mg2+、SO42-等杂质离子,为得到较纯的氯化钠,进行如下的实验操怍①加入过量的Na2CO3溶液;②加入过量的BaCl2溶液③加入过量的NaOH溶液;④加入适量的盐酸调节溶液的pH等于7;⑤过滤;⑥蒸发。下列操作顺序正确的是________(填字母序号),其中操作④加入适量的盐酸调节溶液的pH等于7的目的是________。
A ①③②④⑤⑥
B ③②①④⑤⑥
C ③①②⑤④⑥
D ②③①⑤④⑥
(3)海水资源综合利用的部分途径如图2。
①氨碱工业生产过程中,在加压并不断向饱和的氨盐水中通入二氧化碳的条件下,使碳酸氢钠结晶析出,该反应的化学方程式是________。
②写出步骤Ⅰ电解饱和NaCl溶液的化学方程式是________。
③海水制镁。实际生产中,步骤Ⅲ常选用________作为沉淀剂,从海水中提取MgCl2历经步骤Ⅱ、Ⅲ、Ⅳ三步转换的主要目的是________。
参考答案:
【答案】ABC D 除去溶液过量的氢氧化钠和碳酸钠 NH3+NaCl+H2O+CO2=NaHCO3↓+NH4Cl 2NaCl+2H2O=2NaOH+H2↑+Cl2↑ 熟石灰 提高氯化镁的纯度
【解析】
硫酸根离子和钡离子生成硫酸钡沉淀,镁离子和氢氧根离子生成氢氧化镁沉淀,钙离子和碳酸根离子生成碳酸钙沉淀,氢氧化钠和碳酸钠溶液显碱性,能使无色酚酞溶液变红色。
(1) A、膜分离法的原理是水分子可以通过淡化膜,海水中体积较大的盐的离子和其他分子不能通过,则与滤纸过滤原理类似,故A正确;
B、海水中体积较大的盐的离子和其他分子不能通过膜,则膜分离法还可以浓缩海水中的盐类物质,故B正确;
C 膜分离法也是一种分离混合物的方法,故C正确;
D 膜分离法是除去海水中体积较大的盐的离子和其他分子,故目的是除去海水中的可溶物,故D不正确。故选ABC。
(2)除去难溶性杂质后的食盐水中还含有Ca2+、Mg2+、SO42-等杂质离子,为得到较纯的氯化钠,进行如下的实验操怍:②加入过量的BaCl2溶液,生成硫酸钡沉淀,除去硫酸根离子③加入过量的NaOH溶液,生成氢氧化镁沉淀,除去镁离子①加入过量的Na2CO3液,生成碳酸钙沉淀,除去钙离子⑤过滤固体杂质④加入适量的盐酸调节溶液的pH等于7;⑥蒸发结晶,故操作顺序正确的是②③①⑤④⑥,故选D,其中操作④加入适量的盐酸调节溶液的pH等于7的目的是除去溶液过量的氢氧化钠和碳酸钠。
(3)①氨碱工业生产过程中,在加压并不断向饱和的氨盐水中通入二氧化碳的条件下,碳酸氢钠结晶析出,反应的化学方程式是![]() 。
。
②步骤Ⅰ电解饱和NaCl溶液的生成氢氧化钠和氢气和氯气,化学方程式是![]() 。
。
③镁离子和氢氧根离子生成氢氧化镁沉淀,故步骤Ⅲ常选用熟石灰作为沉淀剂,从海水中提取MgCl2历经步骤Ⅱ、Ⅲ、Ⅳ三步转换的主要目的是提高氯化镁的纯度。
-
科目: 来源: 题型:
查看答案和解析>>【题目】“砂锅鱼头”汤鲜汁浓,其烹饪方法为:将鱼头下油锅煎黄后,放入砂锅中加适量食盐、葱段、生姜、香菜、矿泉水等,在火上煨煮数小时即成。
(1)鱼头中的蛋白质进入人体后会逐步分解成被人体吸收的________。
(2)砂锅鱼头”中几乎不含有的营养素是________(填字序号)。
A 无机盐 B 油脂 C 糖类 D 水
(3)用洗洁精清洗油腻的砂锅是利用洗洁精的________作用。
(4)用液化气灶煨制砂锅鱼头时,砂锅外壁出现黑灰,此时可将灶具的进风口________(填“调大”或“调小”)。液化气的主要成分之一是丙烷(C3H8),丙烷完全燃烧的化学方程式为________3________8________2=________2________2________。
(5)使用液化气灶一定要注意安全,如果液化气一旦泄漏,遇到明火就可能发生爆炸。从微观角度解释发生爆炸的原因是________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】2018年12月8日,搭载着“嫦娥四号”探测器的“长征三号乙”运载火箭发射成功。
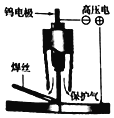
(1)“长征三号乙”火箭发动机在焊接时需要使用氩弧焊。氩弧焊(如图)是在氩气保护下,通过在钨电极与焊件间产生的高压电弧放热,熔化焊丝或焊件的一种焊接技术。
①金属钨作电极是利用了金属钨的导电性和________;用氩气作保护气,是因为氩气的化学性质________。
②如果在没有保护气的情况下焊接金属,可能导致焊接不牢,原因是________。
(2)“长征三号乙”的第一、二子级火箭用偏二甲肼(C2H8N2)和四氧化二氮(N2O4)做推进剂,该反应的化学方程式为C2H8N2+2N2O4=3N2+4H2O+2X,则X的化学式是________2。
(3)“长征三号乙”的第三子级火箭采用液氢、液氧做推进剂,实验室可采用电解水得到氢气和氧气,氢气在与直流电源________极相连的电极上产生。氢能是未来最理想的能源,但目前应用并不广泛的原因是________(答一条即可)。
(4)“嫦娥四号”光伏发电板的主要构成材料是硅,单质硅由石英固体(SiO2)和碳在高温下反应制得,同时产生一种可燃性气体,该反应的化学方程式是________
-
科目: 来源: 题型:
查看答案和解析>>【题目】碳酸钠在生产和生活中都有重要的用途。图一、图二是某兴趣小组探究碳酸钠化学性质时所做的两组实验。实验结束后,将两组实验试管中的物质分别全部倒入甲、乙两个洁净的烧杯中,据图回答。
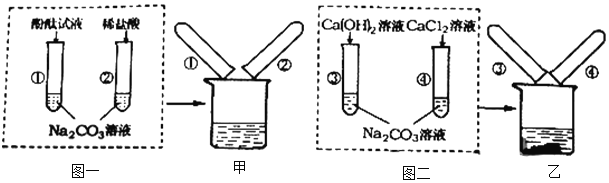
(1)试管①中能够观察到的现象是________。
(2)试管③中发生反应的化学方程式是________。
(3)兴趣小组的同学完成上述实验后,为继续探究酸碱盐之间的反应,又对甲、乙烧杯内的反应混合物进行了如图所示实验,通过分析完成下列问题。
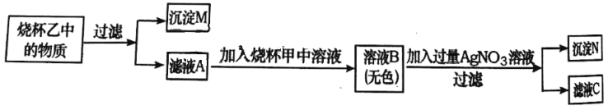
①根据上述实验分析推断,图一中试管②完全反应后所得的溶液中一定含有的溶质是________。
②小组同学把沉淀M、N混合后置于烧杯丙中,向其中加入过量的稀盐酸,观察到的实验现象是________。把烧杯丙中反应后的混合物与滤液C全部倒入废液缸中,反应结束后废液缸内上层溶液中,除酚酞外一定还含有的溶质是________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】我国煤炭资源丰富。某实验室设计的利用水煤浆(由煤和水混合而成)制备氢气的生产工艺如图流程一所示。
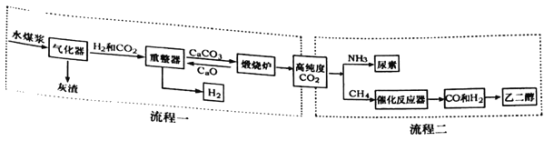
(流程一)制备氢气。
(1)气化器中发生的主要反应为:Ⅰ.H2O+C=CO+H2;Ⅱ.CO+H2O=CO2+H2,其中属于置换反应的是________(填“Ⅰ”或“Ⅱ”),反应Ⅱ中发生还原反应的物质是________2________。
(2)重整器的作用是________。重整器中发生反应的化学方程式是________。
(3)该流程中可以循环使用的物质是________。
(流程二)为充分利用流程一产生的高纯度二氧化碳,该实验室又设计了如图中流程二所示的两种工艺分别制备尿素和乙二醇。
(1)在高温高压下,CO2和NH3可以合成尿素[CO(NH2)2],同时生成水,该反应的化学方程式为________。尿素属于化肥中的________肥,能使作物枝叶繁茂。
(2)以CO和H2为原料生产乙二醇(C2H6O2)时,按照“绿色化学”原则,应调节原料中CO和H2的分子个数比为________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】潜水器中可使用过氧化钠(Na2O2)固体做供氧剂,过氧化钠固体与二氧化碳反应原理是:2Na2O2+2CO2═2Na2CO3+O2,为验证该反应产物,某兴趣小组进行如下实验探究。
(查阅资料)过氧化钠与水反应生成氢氧化钠和氧气。
(设计实验)小组同学利用如图装置进行实(忽略稀盐酸的挥发)。
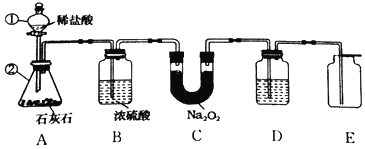
(1)装置A中标号仪器名称:①________,②________。
(2)装置A中反应的化学方程式为________。
(3)装置B的作用是________。
(4)为防止装置E收集的氧气中混有二氧化碳,装置D中盛放的试剂是________溶液。
(5)验证过氧化钠与二氧化碳反应产物
步骤
实验操作
实验现象
实验结论
①
将带火星的木条伸入装置E中
_____
产物中有氧气
②
反应后取装置C中少量固体于试管中,加水完全溶解
_____
固体中有未反应的过氧化钠
③
向步骤②反应后所得溶液中加入足量稀盐酸,有气体产生,将产生的气体通入足量澄清石灰水中
_____
产物中有碳酸钠
-
科目: 来源: 题型:
查看答案和解析>>【题目】2019年5月,187个国家签署了限制塑料废物交易协定,应对“白色污染”挑战。已知某种塑料的组成元素中有碳、氢两种元素,还可能有氧、氯元素中的一种或两种。为了测定其组成,某化学兴趣小组进行如下的探究。
(查阅资料)①无水氯化钙固体可做干燥剂;②有机物中的氯元素燃烧后通常转化为氯化氢。
(设计实验)兴趣小组设计并进行了如图所示的实验。(装置气密性良好)
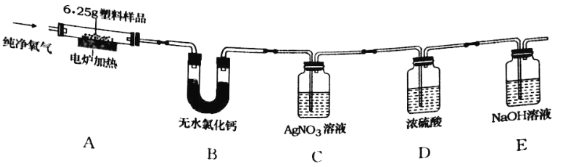
实验过程中,在装置C中观察到________现象,证明该塑料样品中含有氯元素,该反应的化学方程式是________。
(记录数据)6.25g样品在A装置中充分燃烧,反应产物被完全吸收后,测得相关实验数据如表。
装置
B
C
D
E
反应后装置增加的质量/g
1.80
3.65
0.09
8.80
(分析与结论)根据以上数据分析与计算,6.25g样品中氢元素的质量为________g,该塑料样品的组成元素是________。
(反思评价)电炉加热前要先通一会儿氧气,目的是________。
相关试题

