【题目】某化学兴趣小组进行“CO还原氧化铁”的实验(如图),待红色氧化铁完全变成黑色粉末时停止加热,继续通入CO冷却到室温.为检验生成物是否全部为铁粉,他们取出适量的黑色粉末用磁铁验证,发现黑色粉末全部能被磁铁吸引.
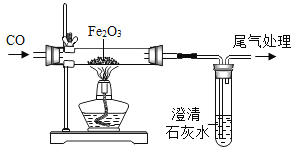
【提出问题】CO还原氧化铁后所得黑色粉末全部是铁粉吗?
【查阅资料】查阅到的相关资料:
(1)CO与氧化铁在570℃以上时,依次发生下列3个反应:
3Fe2O3+CO![]() 2Fe3O4+CO2 Fe3O4+CO
2Fe3O4+CO2 Fe3O4+CO![]() 3FeO+CO2 FeO+CO
3FeO+CO2 FeO+CO![]() Fe+CO2
Fe+CO2
(2)在铁的氧化物中,仅有氧化铁是红色(其余皆是黑色),仅有氧化亚铁在空气中会很快被氧化成氧化铁,仅有四氧化三铁具有磁性.且四氧化三铁不溶于酸、不与酸反应。
【猜想与假设】请你结合课本知识和查到的资料信息,对黑色粉末的组成提出猜想.
猜想①:黑色粉末全部是铁粉;
猜想②:黑色粉末全部是四氧化三铁;
猜想③:黑色粉末________________________.
【实验与结论】请你设计实验验证猜想(假设各组分均能被检出).
A.取样装入试管,_________________,则猜想①正确.
B.取样装入试管,_________________,则猜想②正确。
C.取样装入试管,_________________,则猜想③正确
【反思与拓展】
(1)做“CO还原氧化铁”实验,如何操作才能确保氧化铁被完全还原成铁粉?请你提出1条建议:___________________________.
(2)据报道,大型超市的食品密封包装盒的透明盖内放有少量的氧化亚铁,一旦密封包装破损氧化亚铁就会变为______色,这样售货员就能及时发现.请写出氧化亚铁在空气中自然变色的化学方程式:_________________.
参考答案:
【答案】铁与四氧化三铁的混合物黑色粉末完全溶解并有气泡生成黑色粉末没有溶解无气泡生成黑色粉末部分溶解并有气泡生成控制温度达到570℃以上红4FeO+O2=2Fe2O3
【解析】
【猜想与假设】由于铁与四氧化三铁均能被磁铁吸引,所以黑色固体的成分可能是:全部是铁;全部是四氧化三铁;或者是两者的混合物;
【实验与结论】依据铁能与盐酸反应生成氢气,而四氧化三铁不能与盐酸反应对实验进行设计即可;
【反思与拓展】(1)根据题干中的信息“CO与氧化铁在570℃以上时,依次发生下列3个反应”分析解答;
(2)依据氧化铁的颜色以及题中的信息分析解答;
解:【猜想与假设】由于铁与四氧化三铁均能被磁铁吸引,而该黑色粉末全部能被磁铁吸,所以黑色固体的成分可能是:①全部是铁;②全部是四氧化三铁;③两者的混合物;
【实验与结论】因为铁能与盐酸反应生成氢气,而四氧化三铁不能与盐酸反应,所以①取适量黑色粉末加入足量稀盐酸,黑色粉末完全溶解并有气泡生成,说明该黑色固体全部为铁;②取适量黑色粉末加入足量稀盐酸,黑色粉没有溶解,说明该黑色固体全部是四氧化三铁;③取适量黑色粉末加入足量稀盐酸,黑色粉末部分溶解且有气体放出,则该黑色固体为铁与四氧化三铁的混合物;
【反思与拓展】(1)由于“CO与氧化铁在570℃以上时,依次发生下列3个反应”并最终生成单质的铁,所以要确保氧化铁被完全还原成铁粉,则应控制温度在570℃以上;
(2)依据由于氧化铁的颜色是红色的,所以黑色的氧化亚铁被氧化为氧化铁时,固体会变成红色,反应的方程式为4FeO+O2=2Fe2O3;
故答案为:【猜想与假设】铁与四氧化三铁的混合物.
【实验与结论】取适量黑色粉末加入足量稀盐酸,黑色粉末完全溶解并有气泡生成;
取适量黑色粉末加入足量稀盐酸,黑色粉没有溶解;
取适量黑色粉末加入足量稀盐酸,黑色粉末部分溶解;
【反思与拓展】
(1)控制温度达到570℃以上.
(2)红;4FeO+O2=2Fe2O3.
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图是生活中常用的金属制品:
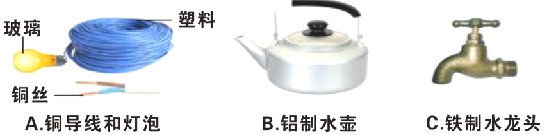
(1)上述金属制品中,利用其导热性的是_______(填序号),铁的金属活动性比铜强,请举例说明______________________(用化学方程式表示)。
(2)钢铁是常用的金属材料,写出工业上用CO和赤铁矿(主要成分是Fe2O3)炼铁的化学方程式:___________________.
(3)铝制品比铁制品具有更好的抗腐蚀性能,是因为铝表面能生成一层_____________,阻止铝进一步被氧化.铁制水龙头易生锈,请写一条能防止铁制品生锈的方法______________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】我国2016年纪念“世界水日”和“中国水周”活动的宣传主题为“落实五大发展理念,推进最严格水资源管理”。请回答下列与水有关的问题:
(1)在生活中,当水的硬度大或者病菌过多,可以采取______的方法降低水的硬度和杀灭病菌,硬水和软水可用________来鉴别;
(2)洗碗时,用洗涤剂清洗油污是利用洗涤剂的 __________作用。
-
科目: 来源: 题型:
查看答案和解析>>【题目】尿素是一种优质的氮肥,其化学式为CO(NH2)2,据此我能计算:
(1)尿素分子中N、H两元素的原子个数比为__________;
(2)一袋50 kg的尿素中所含碳元素的质量是________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究.
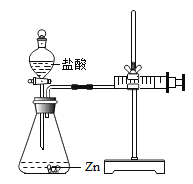
【提出问题】金属与盐酸反应剧烈程度受哪些因素的影响?
【作出猜想】a.可能与金属本身的性质有关
b.可能与盐酸的浓度有关
【设计探究】实验所用金属均已用砂纸打磨.
实验(1)为探究猜想a,小组同学分别在两支试管中放入相同质量的锌片和铁片,然后分别加入等质量、等浓度的稀盐酸,观察到放锌片的试管中立即产生大量气泡,放铁片的试管中只产生少量气泡。写出锌与盐酸发生反应的化学方程式为_______________________.
从实验现象可判断:金属活动性Zn_______Fe(填“<”、’“=”或“>”).
【得出结论】金属与盐酸发生反应的剧烈程度与金属本身性质有关,金属的活动性与反应的剧烈程度的关系是_______.
实验(2)为探究猜想b,小组同学设计如上图的装置进行实验,其中注射器的作用是_______.
所用药品、实验数据如下表:
实验编号
选用金属(均取2g)
盐酸质量分数(均取50mL)
每分钟产生氢气的体积/mL
1分钟
1﹣2分钟
2﹣3分钟
3﹣4分钟
4﹣5分钟
前5分钟共收集气体
Ⅰ
锌片
15%
2.9
16.9
11.9
9.2
7.6
48.5
Ⅱ
锌片
5%
1.6
8.4
5.9
4.8
3.7
24.4
【得出结论】金属与盐酸发生反应的剧烈程度与盐酸的浓度有关,其关系是_________________.
【反思评价】根据表中实验Ⅱ数据分析,请解释锌与盐酸发生反应由慢到快、再由快到慢的原因是_________________________.
【拓展延伸】通过以上探究,你认为金属与盐酸反应的剧烈程度还可能与哪些因素有关?请你帮助他们继续探究.(只要求提出一种影响快慢的相关假设因素及实验方案)
【假设】________________________________.
【实验方案】_____________________________.
-
科目: 来源: 题型:
查看答案和解析>>【题目】化学与我们的生活有着密切的联系。现有①氮气 ②氧气 ③稀有气体 ④二氧化碳
选择适当物质填空(填序号)。
(1)空气中含量居于第二位的物质是 ;
(2)可用作制造霓虹灯的是 ;
(3)焊接金属时常用作保护气的是 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列物质不属于化石燃料的是
A. 石油 B. 煤 C. 酒精 D. 天然气
相关试题

