【题目】水是一种重要的物质,在日常生活生产和实验室中有着不可替代的作用。回答下列问题:
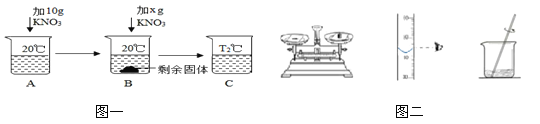
(1)如图一所示,向50g水中加KNO3固体(已知20℃时KNO3的溶解度为31.6g/100g水),当B中KNO3加到 g时,B恰好饱和;图示中B到C的操作可以是 。
(2)若按照图二所示的操作配制10%的食盐溶液,则配制的食盐溶液的浓度会 10%。(填“大于”、“小于”或“等于”)
(3)高铁酸钾(K2FeO4)是一种新型高效的水处理剂,高铁酸钾受热时会发生反应如下:
4K2FeO4 ![]() 2X + 4K2O + 3O2↑,生成物X的化学式是 ,K2FeO4→O2中氧元素由 态变成 态。
2X + 4K2O + 3O2↑,生成物X的化学式是 ,K2FeO4→O2中氧元素由 态变成 态。
(4)海水通常含泥沙和可溶性杂质,净化海水需采取的措施是 (填编号)。
A.沉降 B.过滤 C.吸附 D.蒸馏
参考答案:
【答案】(1)5.8 升温或过滤(2)大于
(3)Fe2O3 化合态 游离态(4)ABCD
【解析】
试题分析:(1)已知20℃时KNO3的溶解度为31.6g/100g水,现在只有50g水,达到饱和状态最多溶解的质量为31.6g÷2=15.8g,故当B中加入KNO3的质量=15.8g=10g=5.8g 恰好饱和;通过图示可知,溶液B为饱和溶液,因为溶液中由未溶解的溶质,要使未溶解的全部溶解,根据硝酸钾的溶解度随温度的升高而增大,故图示中B到C的操作可以是升温或过滤
(2)量筒读数时,视线应与刻度线及凹液面的最低处保持水平,若按照图二所示的操作,量取水的体积偏小,故配制的食盐溶液的浓度会大于10%
(3)根据质量守恒定律的微观解释:在化学反应前后,原子的种类、数目都不变,结合化学反应:4K2FeO4 △ 2X + 4K2O + 3O2↑,可以推出X化学式为 Fe2O3;K2FeO4→O2中氧元素由化合态变成游离态
(4)水净化的步骤有:沉降、过滤、吸附、蒸馏,故净化海水需采取的措施选ABCD
-
科目: 来源: 题型:
查看答案和解析>>【题目】向盛有10g大理石的锥形瓶中逐渐滴加40g未知浓度的盐酸溶液,生成气体的总质量与滴入盐酸溶液的质量关系如图所示,请根据题意回答问题:
①40g盐酸溶液中所含HCl物质的量是 mol。(根据化学方程式列式计算)

②测得该盐酸溶液中溶质质量分数是 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列图像与对应说法相一致的是( )
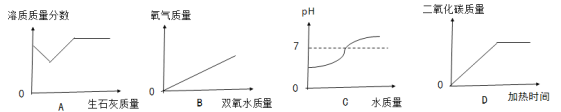
A.向20℃饱和石灰水中加少量生石灰 B.向一定量的MnO2中加入双氧水
C.向盐酸溶液中不断加水 D.高温加热一定量的碳和氧化铜
-
科目: 来源: 题型:
查看答案和解析>>【题目】根据下面所给溶解度曲线的信息回答问题:

(1)t1℃时,a、b、c溶解度由小到大的是
(2)p点含义是
(3)从混有少量b的a溶液中提取较纯a的操作是
(4)t2℃时等质量的a、b、c三种物质的饱和溶液,分别降温到t1℃,
所得溶液中
Ⅰ. 溶剂质量关系:a>b>c Ⅱ.溶质质量关系:b>a = c
Ⅲ.溶液的溶质质量分数关系:b>a>c Ⅳ.溶液质量关系:c>b>a
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列方法能鉴别空气、氧气和二氧化碳3瓶气体的是
A. 闻气味 B. 将集气瓶倒扣在水中
C. 观察颜色 D. 将燃着的木条伸入集气瓶中
-
科目: 来源: 题型:
查看答案和解析>>【题目】关于溶液的下列说法正确的是
A.任何溶液都只能含有一种溶质
B.将硝酸钾固体溶于水时加热,既可以使硝酸钾溶得更快,又能使其溶得更多
C.向水中加入少量蔗糖固体可增强水的导电性
D.一定温度下,任何物质都可以无限制溶解在一定量的水中
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验室里小明利用下图所示装置进行了一系列的实验活动。

(1)B装置中仪器Ⅰ的名称: 。
(2)用二氧化锰与氯酸钾制取氧气,应选用的发生装置是 (填编号),若用装置E来收集氧气,则气体应从 端进入(填a或b)。
(3)小明在B中加入试剂 (填名称)和稀盐酸,与F装置组合进行实验,B中反应的化学方程式是 ;F中硬质玻璃管内发生的反应化学方程式为 ,小明进行该实验的目的是 。为节约资源,小明需要控制B中反应的发生和停止,他可从下列装置中选择 装置代替B装置。(填编号)

相关试题

