【题目】小明在市场看到,鱼老板将一勺白色粉末加入水中,水中奄奄一息的鱼很快张开嘴,活蹦乱跳起来,小明对这种“白色粉末”很感兴趣,与小刚进行了相关探究。
【查阅资料】这种“白色粉末”的主要成分是过碳酸钠(化学式为Na2CO4),常温下,与水反应生成氧气。
【实验1】小明选用如图所示装置中的________(填序号)进行过碳酸钠与水的反应并收集产生的气体,经检验该气体是氧气,检验方法是______________________________________________________。
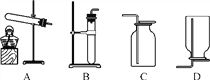
【提出问题】过碳酸钠与水反应后得到的溶液M中溶质的成分是什么?
【作出猜想】根据过碳酸钠与水的组成作出三种猜想。
猜想一:Na2CO3;猜想二:NaOH;猜想三:Na2CO3和NaOH。
【实验2】小明取溶液M,滴加CaCl2溶液,观察到有白色沉淀生成,他认为白色沉淀是CaCO3,溶液中一定含有Na2CO3。小刚提出质疑,产生的白色沉淀不一定是CaCO3,他的理由是_________________________________。
【实验3】小刚取溶液M,滴加稀HCl,观察到________________,证明溶液中一定含有Na2CO3,从而否定了猜想二。Na2CO3与稀HCl反应的化学方程式为________________________。
【实验4】为进一步确定溶液M中是否含有NaOH,他们向溶液M中滴加CaCl2溶液至不再产生沉淀为止,取上层溶液,加入________________,无明显现象。证明溶液中无NaOH溶液,猜想一正确。该实验中用CaCl2溶液而不用饱和石灰水,原因是______________________________________________________。
【反思拓展】
(1)根据过碳酸钠的性质,保存时应注意防潮。
(2)检验A、B两种物质是否同时存在,一定要考虑二者性质的互相干扰问题。
参考答案:
【答案】 B 将燃着的木条放入集气瓶内,木条燃烧得更旺,证明是氧气 氯化钙与氢氧化钠反应,生成微溶性的氢氧化钙 有气泡产生 Na2CO3+2HCl===2NaCl+CO2↑+H2O 无色酚酞试液 碳酸钠能与氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,无法证明原溶液中否含有氢氧化钠
【解析】(1).固体与液体常温下反应制取气体应选择发生装置 B; (2). 氧气的验证方法是:将燃着的木条放入集气瓶内,木条燃烧得更旺,证明是氧气 (3). 氯化钙和氢氧化钠溶于水,分别产生自由的离子:钙离子、氯离子、钠离子和氢氧根离子,所以氯化钙与氢氧化钠溶液也看做是氢氧化钙和氯化钠的混合溶液,而氢氧化钙 是微溶物,会在溶液中出现白色沉淀(析出的氢氧化钙固体); (4).盐酸和碳酸钠反应生成氯化钠、二氧化碳气体和水,因而有气泡产生; (5).反应方程式为: Na2CO3+2HCl===2NaCl+CO2↑+H2O (6). 溶液M中滴加CaCl2溶液至不再产生沉淀为止,将溶液中的碳酸钠除尽,取上层溶液,加入 无色酚酞试液,试液变红,说明有氢氧化钠,反之,无氢氧化钠; (7). 实验中用CaCl2溶液而不用饱和石灰水,原因是碳酸钠能与氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,无法证明原溶液中否含有氢氧化钠。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列物质是由离子构成的是
A.氯化钠 B.氮气 C.汞 D.磷
-
科目: 来源: 题型:
查看答案和解析>>【题目】把下列物质分别放入适量水中,充分搅拌,能够得到溶液的是
A.石灰石 B.冰 C.植物油 D.酒精
-
科目: 来源: 题型:
查看答案和解析>>【题目】选用下列物质填空:①氮气②二氧化碳③氦气④氧气
(1)可用于制霓虹灯的是 (填序号,下同);
(2)可用于焊接金属保护气的是 ;
(3)可用于人工降雨的是 ;
(4)能供给呼吸,支持燃烧的是 .
-
科目: 来源: 题型:
查看答案和解析>>【题目】今年世界环境日,我国提出了“改善环境质量,推动绿色发展”的主题。下列行为符合这一活动主题的是( )
A. 露天焚烧垃圾 B. 大力发展燃煤发电
C. 加高烟囱将工厂废气排放到大气中 D. 鼓励骑“共享单车”出行
-
科目: 来源: 题型:
查看答案和解析>>【题目】人被蚊虫叮咬后,蚊虫在人的皮肤内分泌出蚁酸,使叮咬处又痛又痒。化学小组同学对蚁酸产生了浓厚的兴趣,决定对其进行探究。
【提出问题】蚁酸的成分是什么?它有什么性质?
【查阅资料】
Ⅰ.蚁酸是一种有机酸,化学名称叫做甲酸,化学式为HCOOH;
Ⅱ.蚁酸在隔绝空气并加热的条件下会分解生成两种氧化物。
【实验探究】
(1)小芳同学根据蚁酸中含有________元素,推测出一种生成物是水;
(2)另一种生成的氧化物是气体,小敏提出两种猜想:
①猜想Ⅰ:该气体是CO2;猜想Ⅱ:该气体是________。
他们将蚁酸分解产生的气体通过下图的装置。

②实验时装置A中无明显变化,则猜想Ⅰ________(填“成立”或“不成立”)。
③实验时装置B的作用是_________________________________。
④实验时装置C中的现象是____________________________________________。
⑤实验时装置D中发生反应的化学方程式为________________________。
【讨论交流】从环保角度看,该装置存在明显的缺陷,处理方法是___________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列说法错误的是
A.原子的质量几平都集中在原子核上
B.原子通过得失电子形成离子,但离子不能形成原子
C.原子、分子、离子、电子都是构成物质的微粒.
D.由分子构成的物质发生化学变化时,分子本身改变
相关试题

