【题目】为了测定石灰石中碳酸钙的质量分数,将石灰石粉碎,取粉末10 g,放入烧杯中,做如下实验(假设石灰石样品中杂质不与稀盐酸反应,也不溶于水),请回答下列问题:

(1)配制100 g质量分数为7.3%的稀盐酸,需要质量分数为36.5%的浓盐酸的质量是_______;
(2)写出碳酸钙发生反应的化学方程式为__________________;
(3)设碳酸钙质量为x,写出求解10g石灰石粉末中碳酸钙质量的比例式为____________;则石灰石中碳酸钙质量分数为_________。
(4)将所得的固液混合物过滤,并将滤液蒸发2.8g水(不考虑HCl蒸发),发现无晶体析出,则此时滤液中氯化钙的质量分数是______。
参考答案:
【答案】 20g CaCO3+2HCl==CaCl2+H2O+CO2↑ 100/44==X/2.2g [或==X/(10g+100g—107.8g](另一个比例式合理也给分) 50% 5.55%
【解析】(1).设配制100 g质量分数为7.3%的稀盐酸,需要质量分数为36.5%的浓盐酸的质量是为x,则(1)100 g× 7.3%=36.5%×x , x= 20g (2)碳酸钙和盐酸发生反应生成氯化钙、二氧化碳、水,化学方程式为CaCO3+2HCl==CaCl2+H2O+CO2↑;(3),由质量守恒定律可知,反应前后物质的总质量不变,所以生成二氧化碳的质量为,10g+100g-107.8g=2.2g,设碳酸钙质量为x,CaCO3+2HCl==CaCl2+H2O+CO2↑;
100 44
X 2.2g
100:x=44:2.2g
X=5g, 则石灰石中碳酸钙质量分数为5g÷10g×100%=50%,
设生成氯化钙的质量为y
CaCO3+2HCl==CaCl2+H2O+CO2↑;
111 44
y 2.2g
111/y=44/2.2g
y=5.55g 则此时滤液中氯化钙的质量分数5.55g ÷(107.8g-2.8g-5g)×100%=5.55%
-
科目: 来源: 题型:
查看答案和解析>>【题目】分类、类比是同学们学习化学获取知识的重要科学方法。
(1)氧化反应在生活中随处可见,下面是常见的氧化反应:




A动植物呼吸
B生活火灾
C金属锈蚀
D火药爆炸
请你将上述氧化反应平均分成两组,其中一组是__________;比较B和D,图D发生的现象除了具备B中条件外,还必须具备的另一个条件是________________。
(2)在元素周期表中,C与Si所处的位置及结构如图
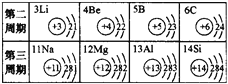
已知二氧化碳与氢氧化钠溶液反应如下
CO2+2NaOH=Na2CO3+H2O
装有氢氧化钠溶液的细口瓶,瓶口磨砂后暴露出SiO2,请你写出二氧化硅与氢氧化钠溶液的反应方程式为_________________,生成物是玻璃胶的成分,因此装有氢氧化钠溶液的细口瓶应用__________塞。
-
科目: 来源: 题型:
查看答案和解析>>【题目】三毛在实验室中做实验时,通过测定某物质中只含有一种元素,因此对该物质作了以下推断,你帮他选择一下哪种说法是正确的
A.该物质可能是单质 B.该物质一定是混合物
C.该物质一定不是化合物 D.该物质一定是纯净物
-
科目: 来源: 题型:
查看答案和解析>>【题目】学习化学过程中有许多“不同”.下列对“不同”的分析错误的是( )
A.CO与CO2性质不同﹣﹣分子构成不同
B.铁丝与铜丝化学性质不同﹣﹣构成的原子不同
C.金刚石与石墨性质不同﹣﹣由不同碳原子构成
D.O2急救病人而O3则不能﹣﹣性质不同
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列实验操作的方法中正确的是
A. 将pH试纸浸入溶液中测溶液的pH
B. 用100 mL的量筒量取5.55 mL的稀硫酸
C. 将氢氧化钠固体直接放在托盘天平的托盘上称量
D. 配制10%的氯化钠溶液的主要步骤是:计算、称量、溶解
-
科目: 来源: 题型:
查看答案和解析>>【题目】纳米材料具有特殊的性质和功能.纳米二氧化钛(TiO2)参与的光催化反应可使吸附在其表面的甲醛等物质被氧化,降低空气中有害物质的浓度.正钛酸(H4TiO4)在一定条件下分解失水可制得纳米TiO2.下列说法不正确的是
A.甲醛对人体健康有害
B.纳米TiO2添加到墙面涂料中,可消除甲醛
C.纳米TiO2与普通的TiO2的性质、功能完全相同
D.制备纳米TiO2的反应:H4TiO4
 TiO2+2H2O
TiO2+2H2O -
科目: 来源: 题型:
查看答案和解析>>【题目】现有X、Y、Z三种金属,将X、Y分别放入稀硫酸溶液中,结果Y表面产生氢气,X无变化,另取X放入Z的盐溶液中,结果X表面有Z析出,则X、Y、Z三种金属的活动顺序是
A. X>Y>Z B. Y>Z>X C. X>Z>Y D. Y>X>Z
相关试题

