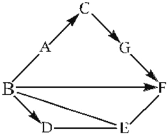
【题目】A~G 是初中化学中常见物质,其中 A、B、D、E、F 所属物质类别均不相同。A、G均为黑色固体,A、C 是生活中常见的两种金属单质,D 是参与光合作用的气体;F 的水溶液呈蓝色,常用于配制波尔多液。它们之间的关系如下图所示(其中“→”表示转化关系,“—”表示相互之间能反应,部分反应物、生成物及反应条件省略)。
请回答下列问题:
(1)D 是 _____ ,G 是 _______(均填化学式)。
(2)写出物质转化的化学反应方程式:
A→C: _____________ ,B→F: _________________ 。
(3)E 的水溶液中一定含有的阴离子是 _______(填化学符号),E 与 F 的溶液反应现象为 ______________ 。
(4)上图中未出现的基本反应类型是 ________________ 。
参考答案:
【答案】CO2 CuO Fe+CuSO4=FeSO4+CuCuO+H2SO4=CuSO4+H2OOH-产生蓝色沉淀 分解反应
【解析】
A~G 是初中化学中常见物质,其中 A、B、D、E、F 所属物质类别均不相同。D是参与光合作用的气体,D是二氧化碳,F的水溶液呈蓝色,常用于配制波尔多液,F是硫酸铜,B能生成硫酸铜,能生成二氧化碳,能与金属单质A反应,B可能是硫酸;A为黑色固体,A是单质,A是铁;铁能生成金属单质C,C生成的黑色固体,G能生成硫酸铜,C可能是铜,G是氧化铜,硫酸、二氧化碳、硫酸铜都能与E反应, E可能是氢氧化钠。
(1)根据上述分析可知:D是二氧化碳,化学式为CO2,G是氧化铜,化学式是CuO;
(2)A→C是铁与硫酸铜反应生成硫酸亚铁和铜,反应的化学方程式是Fe+CuSO4=FeSO4+Cu;B→F是氧化铜和硫酸反应生成硫酸铜和水,反应的化学方程式是CuO+H2SO4═CuSO4+H2O;
(3)E是氢氧化钠,水溶液中一定含有的阴离子是氢氧根离子,化学符号为OH-,氢氧化钠和硫酸铜反应生成蓝色的氢氧化铜沉淀和硫酸钠,反应现象为产生蓝色沉淀;
(4)G→F是氧化铜与硫酸反应生成硫酸铜和水,B→F是氧化铜和硫酸反应生成硫酸铜和水,B→D可以是碳酸钠与硫酸反应生成硫酸钠、水和二氧化碳,B—E的反应是氢氧化钠与硫酸反应生成硫酸钠,E—F的反应是氢氧化钠与硫酸铜反应生成氢氧化铜和硫酸钠,以上反应都是由两种化合物互相交换成分,生成另外两种化合物的反应属于复分解反应;反应C→G是铜和氧气反应生成氧化,该反应是由两种或两种以上的物质生成另一种物质的反应属于化合反应;A—B的反应是铁与硫酸反应生成硫酸亚铁与氢气,该反应是由一种单质与一种化合物反应,生成另一种单质和另一种化合物的反应属于置换反应。图中未出现的基本反应类型是分解反应。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图是甲、乙、丙三种固体物质的溶解度曲线,下列说法正确的是
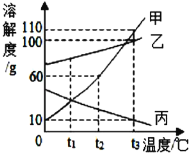
A. t1℃时,甲的溶解度等于丙的溶解度
B. t2℃时,100 g 甲的饱和溶液中含有 60 g 甲物质
C. 若甲中含有少量的乙,则提纯甲的方法是蒸发结晶
D. t1℃时,将甲、乙、丙三种物质的饱和溶液同时升温到 t3℃,不考虑水分蒸发,所得溶液中溶质的质量分数最大的是乙
-
科目: 来源: 题型:
查看答案和解析>>【题目】碘循环工艺不仅能吸收 SO2,同时又能制得 H2,工艺流程如下图。下列说法正确的是
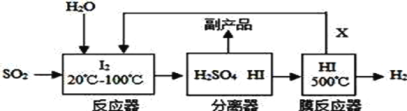
A. 上述工艺流程中硫元素的化合价没有发生改变
B. 该碘循环工艺能减少 SO2 对环境的污染
C. 该流程中能循环使用的物质是 H2SO4 和 I2
D. 该循环工艺过程的总反应方程式为 SO2+2H2O
 H2SO4+H2
H2SO4+H2 -
科目: 来源: 题型:
查看答案和解析>>【题目】人类的生存与发展离不开化学
(1)生活中常把榨好的蔬菜汁放到面粉中做成蔬菜馒头,这种馒头提供的主要营养物质是糖类和 _____________ 。
(2)木材着火,用水浇灭,其原理主要是 ___________________ 。
(3)化石燃料是 _______________(填“可再生”或“不可再生”)能源。“可燃冰”有可能成为人类未来的重要能源,其主要成分为甲烷(CH4),分类上属于 ________(填“无机物”或“有机物”)。
(4)铁是应用最广泛的金属。喷漆能防止铁生锈,原因是____________________ ;工业炼铁时,一氧化碳和赤铁矿(主要成分是氧化铁)发生的主要反应的化学方程式为 _____ 。
(5)水是生命之源,合理利用和保护水资源是我们义不容辞的责任。
① 硬水有害健康,可以用 ________________ 鉴别硬水和软水。生活中既能降低水的硬度,又能杀菌消毒的方法是 ______________ 。
② 生活中含磷洗涤剂的过量使用是导致水体富营养化,水质恶化的因素之一。这里的“磷”是指 _____________(填选项序号)。 A.元素 B.原子 C.离子 D.分子
-
科目: 来源: 题型:
查看答案和解析>>【题目】我国化工专家侯德榜发明了侯氏制碱法,为世界制碱工业作出了突出贡献。
(1)主产品 Na2CO3的俗名为_______ ,副产品氯化铵在农业上常可用作________ 。
(2)工业制法获得的 Na2CO3中常含有 NaCl 杂质,用下述方法可以测定固体样品中NaCl的质量分数。请分析实验操作流程,回答下列问题:

①“研磨”的目的是_________________________ 。
②“滤液”中溶质的成分是 ________________(填化学式)。
③“操作”主要有过滤、洗涤、低温烘干、冷却和称量,其中“检验沉淀是否洗涤干净”所用的试剂为 _______________溶液(填化学式)。
④计算 11 g 固体样品中 NaCl 的质量分数(计算结果精确到 0.1%)___________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】学习化学离不开实验
(实验一)请根据下图装置,回答相关问题:
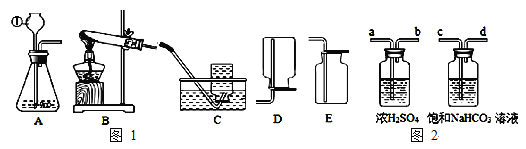
(1)仪器①的名称为 __________________ 。
(2)实验室加热高锰酸钾固体制取一瓶氧气,来做铁丝燃烧的性质实验,应从图 1 中选用的收集装置是______(填装置编号)。用高锰酸钾制取氧气的化学方程式为 __________ 。
(3)实验室用大理石和稀盐酸反应制取的二氧化碳中,常含有少量的水蒸气和氯化氢气体,用图2 装置可得到干燥、纯净的二氧化碳,导管气流方向连接顺序正确的是 ______(填选项序号)。A.a→b→c→d B.a→b→d→c C.c→d→a→b D.d→c→a→b
(实验二)实验室从氯酸钾和二氧化锰完全反应后的固体混合物中回收二氧化锰和获得产物氯化钾,并配制 100 g 7.5%的氯化钾溶液。
(1)从完全反应后的固体混合物中获得氯化钾的步骤是:溶解→(__________)→蒸发
(2)蒸发时玻璃棒的作用为 ________________ 。
(3)将配制得到的氯化钾溶液装瓶并贴标签。请填写右侧的标签。
 _______________
_______________(4)配制得到的溶液溶质质量分数偏小,其原因可能有 _____________(填序号)。
① 氯化钾固体不纯 ② 砝码生锈了
③ 量取水时仰视读数 ④ 装瓶时,有少量溶液洒出
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列实验操作正确的是( )
A.
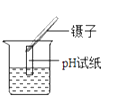 测定溶液的pH B.
测定溶液的pH B.  蒸发结晶
蒸发结晶C.
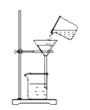 过滤 D.
过滤 D. 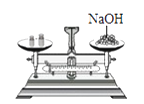 称量氢氧化钠固体
称量氢氧化钠固体
相关试题

