【题目】下图是“”补钙剂的商品标签图。

小蓉同学为测定其碳酸钙的含量标注是否属实,她取出4片片剂,研碎后放入烧杯中.逐滴加入稀盐酸,至不再放出气体为止,共用去稀盐酸40.0g,称量烧杯中剩余物质的质量为47.8 g(不含烧杯要量,假定钙片中其他成分不与盐酸反应)。反应的化学方程式为:
CaCO3+2HCl===CaCl2+H2O+CO2↑.求:
(1)生成二氧化碳的质量。
(2)通过计算判断钙片中碳酸钙的含量标注是否属实。
参考答案:
【答案】(1)2.2 g (2)标注属实
【解析】(1)由质量守恒定律可知反应前后物质的总质量不变,所以生成二氧化碳的质量为:4片×2.5g/片+40.0g-47.8 g=2.2g。
(2)设4片钙片中碳酸钙的质量为x
CaCO3+2HCl===CaCl2+H2O+CO2↑
100 44
X 2.2 g
100/x=44/2.2g x=5g
每片钙片中碳酸钙的质量为:5g÷4片=1.25g/片≥1.24g/片;
标注属实
-
科目: 来源: 题型:
查看答案和解析>>【题目】某学习小组的同学为探究金属的化学性质做了如下实验:分别用细砂纸打磨铝片和铁片的表面,打磨后将其放置在空气中进行观察,并将观察结果记录如下:

(1)通过上述实验事实,你能得出什么结论?
(2)通常情况下,看到铁生锈而看不到铝生锈,其原因是什么?
(3)上述事实告诉我们,在清洗铝制品时应注意什么?
-
科目: 来源: 题型:
查看答案和解析>>【题目】某校化学探究性学习小组的同学在学习了《金属与矿物》一章后,做了如下图所示的探究实验。实验发现CO与CuO加热后,黑色粉末变成红色粉末。请你参与该小组的探究过程并回答下列问题。
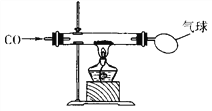
【探究课题】探究红色粉末的主要成分。
【查阅资料】
(1)有关物质的颜色:CuO粉末黑色,Cu2O粉末红色。
(2)CuO和Cu2O都能和稀硫酸发生反应,化学方程式:
CuO+H2SO4===CuSO4+H2O Cu2O+H2SO4===CuSO4+Cu+H2O
【猜想与实验】
(1)如果硬质玻璃管内红色粉末为一种物质,请猜想它的成分,并设计简单的实验证明你的猜测。________________________________
(2)如果硬质玻璃管内红色粉末为两种物质的混合物,要确定粉末中两种物质的质量分数,还需要通过有关数据计算进行判断。下列数据不可作为计算依据的是 (______)
A.反应前CuO粉末的质量 B.硬质玻璃管中固体物质减少的质量
C.通入CO的质量 D.反应后固体混合物的总质量
-
科目: 来源: 题型:
查看答案和解析>>【题目】小明按下图安装好实验装置(两胶头滴管中的稀盐酸浓度和体积都相等),实验时,同时完全捏瘪两滴管的胶头.并观察实验现象。
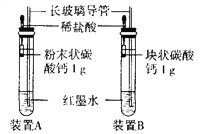
(1)小明的实验目的是_________________________。
(2)装置中长玻璃导管的作用是___________; 红墨水的作用是______________。
(3)你估计两根长玻璃导管中的实验现象是__________;理由是____________.
-
科目: 来源: 题型:
查看答案和解析>>【题目】现有氧气、硫酸铜溶液、铁、碳酸钙四种物质,从中选择合适的物质作反应物,按以下要求各写一个化学方程式。
(1)分解反应:_________________________。
(2)化合反应:_________________________。
(3)置换反应:_________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】日本曾向美国借了331公斤武器级钚,至今赖着不还,钚除用于核电外,还可用于制造核武器,现在日本已是世界第六大钚贮存国。钚元素的有关信息如图,下列说法正确的是( )
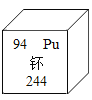
A. 钚原子中有94个中子 B. 钚原子核外有150个电子
C. 钚的相对原子质量是244g D. 钚是金属元素
-
科目: 来源: 题型:
查看答案和解析>>【题目】根据图实验回答问题。
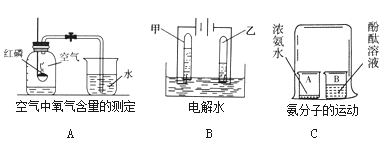
(1)A实验中白磷燃烧的文字(符号)表达式:____________________________________实验结束待集气瓶冷却后,进入集气瓶中水的体积小于集气瓶容积的五分之一,可能的原因是_______________________(填一条即可)。该实验不能用木炭代替红磷,理由是________________________________________。
(2)B实验中发生反应的文字(符号)表达式:___________________________;乙试管中产生气体的名称是________.
(3)C实验中,无色的酚酞溶液变成红色.由此说明分子具有的性质是__________________;浓氨水具有的物理性质是______________ 。
相关试题

