【题目】臭氧(O3)是对于环境有重要影响的物质,兴趣小组对其进行如下探究。
【查阅资料】①O3微溶于水:
②O3常用于消毒等,但浓度超标时对人体有毒副作用;
③品红溶液为红色,遇强氧化剂(如O3)会变味无色。
探究一·臭氧的制备
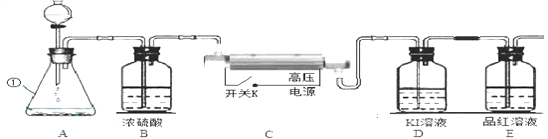
(1)写出仪器①名称___________。
(2)图中A装置制取氧气的化学方程式是______________。
(3)将A中制得的氧气一次通过图中B→E装置。
①B中浓硫酸的作用是____________________。
②实验开始,先通过一段时间氧气,合上C装置电源开关,在电火花作用下O2会转化为O3,该反应是____(填“物理”或“化学”)变化。
探究二·臭氧含量的测定
D中反应原理为:2KI+O3+H2O 2KOH+I2+O2,当E中出现现象时,可知D中反应完全。从安全、环保角度看,上述装置不足之处是____________。
(6)若D中生成碘12.7mg,则理论上应吸收O3_______mg(O3、I2的相对分子质量分别为48.254)。
探究三·影响臭氧分解的因素
O3在水中易分解,一定条件下,某浓度的O3在浓度减少一半所需的时间(t)如下表所示。
温度 分钟 pH | 3.0 | 4.0 | 5.0 | 6.0 |
20 | 301 | 231 | 169 | 58 |
30 | 158 | 108 | 48 | 15 |
40 | 31 | 26 | 15 | 7 |
(7)①分析表中数据,臭氧的分解速率与___________、___________有关。
②据表推测O3在下列条件下分解速率从小到大的顺序为___________(填序号)。
a.20℃、pH=3.0 b.30℃、pH=4.0 c.50℃、pH=6.0
③臭氧在水中分解是臭氧与水反应生成氧气和过氧化氢,反应的化学方程式为__________。
参考答案:
【答案】 锥形瓶 2H2O2![]() 2H2O+O2↑ 吸收水分(或干燥) 化学 品红溶液褪色 没有对尾气进行处理 2.4 pH、温度 abc O3+H2O=O2+H2O2
2H2O+O2↑ 吸收水分(或干燥) 化学 品红溶液褪色 没有对尾气进行处理 2.4 pH、温度 abc O3+H2O=O2+H2O2
【解析】探究一、(1)仪器①的名称是:锥形瓶;(2)图中A装置制取氧气为固液不加热型,实验室可用过氧化氢和二氧化锰制取氧气,化学方程式是:2H2O2![]() 2H2O+O2↑;(3)①B中浓硫酸的作用是吸收水分(或干燥);在电火花作用下O2会转化为O3,有新物质生成,该反应是化学变化;探究二、臭氧(O3)是对于环境有重要影响的物质,浓度超标时对人体有毒副作用,从安全、环保角度看,上述装置不足之处是没有对尾气进行处理;(6)若D中生成碘12.7mg,设理论上应吸收O3
2H2O+O2↑;(3)①B中浓硫酸的作用是吸收水分(或干燥);在电火花作用下O2会转化为O3,有新物质生成,该反应是化学变化;探究二、臭氧(O3)是对于环境有重要影响的物质,浓度超标时对人体有毒副作用,从安全、环保角度看,上述装置不足之处是没有对尾气进行处理;(6)若D中生成碘12.7mg,设理论上应吸收O3![]() mg,
mg,
2KI+O3+H2O==2KOH+I2+O2
48 254
X 12.7mg
![]() ,
, ![]() =2.4mg;探究三、(7)①分析表中数据,臭氧的分解速率与 pH、温度有关;②据表推测,温度越高,分解速率越快;pH值越大,分解速率越快;O3在下列条件下分解速率从小到大的顺序为abc;③臭氧在水中分解是臭氧与水反应生成氧气和过氧化氢,反应的化学方程式为:O3+H2O=O2+H2O2。
=2.4mg;探究三、(7)①分析表中数据,臭氧的分解速率与 pH、温度有关;②据表推测,温度越高,分解速率越快;pH值越大,分解速率越快;O3在下列条件下分解速率从小到大的顺序为abc;③臭氧在水中分解是臭氧与水反应生成氧气和过氧化氢,反应的化学方程式为:O3+H2O=O2+H2O2。
-
科目: 来源: 题型:
查看答案和解析>>【题目】有一包粉末,已知由BaSO4、FeCl3、Ba(NO3)2、Na2SO4、NaOH、NaCl中的几种组成。为了确定其成分,现进行以下实验,各步骤均已充分反应。
步骤一:取一定质量的粉末,加水搅拌后过滤,得到有色沉淀甲和无色溶液A;
步骤二:向步骤一的沉淀甲中加入足量稀盐酸,固体全部消失并得到黄色溶液;
步骤三:将步骤一得到的无色溶液A进行如下图所示的实验。
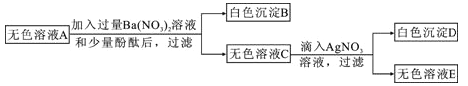
则下列说法中正确的是:
A. 原白色粉末中一定有FeCl3、Na2SO4、NaOH
B. 有色沉淀甲可能是Fe(OH)3和BaSO4 的混合物
C. 若将步骤二中的盐酸换成硝酸,则可确定原白色粉末是否含有NaCl
D. 原白色粉末中FeCl3和NaOH的质量比为65:48
-
科目: 来源: 题型:
查看答案和解析>>【题目】化学用语是学习化学的重要工具
(1)按要求写出相应的化学符号
①碳原子_____②空气中最多的气体_______③锌离子______④两个碳酸根离子______
⑤缺少后会导致骨质疏松的元素_________⑥“西气东输”中的“气”是_______
(2)按要求写出相应的化学方程式,并注明反应的基本类型
①铝在空气中形成致密的保护膜________________________,反应类型____________
②用氢氧化镁治疗胃酸过多_______________________,反应类型____________
③水在通电条件下分解________________________,反应类型____________
④用锌与稀硫酸反应制取氢气________________________,反应类型____________
-
科目: 来源: 题型:
查看答案和解析>>【题目】化学与生活密切相关。
Ⅰ.在“①稀硫酸、②水、③熟石灰、④酒精、⑤氯化钾、⑥铁粉”中,请选择适当物质的序号填空:
(1)用于改良酸性土壤的是____________, (2)用于清除铁锈的是_________,
(3)实验室常用的液体燃料是____________, (4)最常见的溶剂____________,
(5)用于防止食物变质的双吸剂____________, (6)可作钾肥的是____________。
Ⅱ.合现有下列五种物质A. 食盐 B. 小苏打 C. 苹果 D. 葡萄糖 E. 维生素A
请按下列要求填空(填序号)。
富含维生素C的是___________;可直接进入血液,补充能量的是________;既可作为疏松剂,又可治疗胃酸过多的是________;食用过多会引起血压升高的________;夜盲症患者可以在医生的指导下补充大量________进行治疗。
Ⅲ.材料是人类生产和生活的物质基础,合理使用材料可以改善我们的生活。
(1)钢铁的生产与使用是人类文明和生活进步的一个重要标志。
①工业上用赤铁矿炼铁的主要化学反应方程式:_______________________________,实验室完成此实验是要注意先____________再___________,目的是为了_____________ 。
②我们还可以采用湿法冶金获得金属,请写出铁与硫酸铜溶液反应的化学方程式: ______________。
③ 炒过菜的铁锅未及时洗净擦干,第二天便会因腐蚀出现红褐色锈斑。铁锅的腐蚀主要是铁与_______和_______反应造成,铁锈的主要成分是________。为防止铁制品锈蚀,可采取的方法有_____________(只需填写一种即可)。
(2) 体育场馆建设需大量建筑材料。下列材料属于复合材料的是________(填字母) ,属于合成材料的是________(填字母)。
a. 石灰石 b. 玻璃钢 c. 玻璃 d 钢筋混凝土 e 聚氯乙烯塑料
Ⅳ.化学的发展为人类解决能源危机带来了曙光。
(1)化学电池是一种高效利用能源的装置,电池在使用时将_______能转化为_______能
(2)下图是某电池的内部结构示意图,
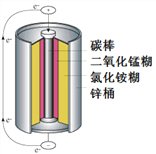
①其中正极为_______,负极为_______。
②请写出用二氧化锰和双氧水混合制取氧气的化学方程式__________________。
③电池材料中的糊状电解质中含有淀粉,我们可以用________(填试剂名称)来检验,检验时课观察到__________________。
④电解液中的氯化铵,再农业生产中可做______肥,施用时要注意__________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某同学逛超市时发现食品添加剂中有“碳酸氢铵”,感觉很惊讶,“碳酸氢铵”是臭粉啊,怎么可以放进食品?于是开展了以下探究,请你帮助完成下列相关问题。
(1)查阅资料:
①食用级碳酸氢铵比较纯净,可作膨松剂,一般用在油炸食品中,水蒸食品中不用;
②常温常压下,1体积水约能溶解600体积氨气,其水溶液呈弱碱性。
③碱石灰是氧化钙和氢氧化钠的混合物。
(2)产生疑惑:臭粉为何可以作膨松剂?为何一般适用于油炸食品而不适用于水蒸食品?
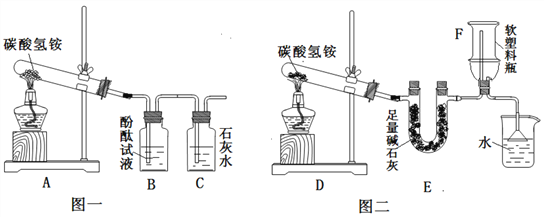
(3)实验设计:实验装置如图,图一是检验装置,图二是收集装置,取适量碳酸氢铵分别置于两试管中,按如图进行实验。
(4)现象与分析:
①图一:B中现象是_________________,C中发生反应的化学方程式是 _______________ 。
②图三:装置E的作用是_________________,用F装置收集氨气,说明氨气具有_________________性质,取下F,塞紧橡皮塞,用注射器向F中注入少量水,震荡,可看到的现象是_________________,拔出橡皮塞闻到氨味。
(5)解释与结论:①有臭味的碳酸氢铵添加到食品中,如果油炸,则含有的少量碳酸氢铵受热时完全分解,产生的气体使食品膨胀,且生成物可以迅速挥发而离开食品,没有残留物,其臭味会消失,碳酸氢铵受热发生反应的化学方程式是_________________②添加碳酸氢铵的食品如果水蒸,则 _________________。
通过上述探究该明白了:高纯度的碳酸氢铵可以作为食品添加剂,但同一食品添加剂并不适合所有食品,使用食品添加剂需严格控制用量。
-
科目: 来源: 题型:
查看答案和解析>>【题目】过氧化钙晶体(化学式为:CaO2·yH2O,化学式中的“yH2O”称为结晶水),常温该晶体下为白色,能溶于酸,难溶于水、乙醇,是一种温和的氧化剂,常用于鱼类长途运输的增氧剂等。
(1) 过氧化钙晶体可用下列方法制备:
CaCl2+H2O2+NH3+H2O
 CaO2·yH2O↓+NH4Cl。
CaO2·yH2O↓+NH4Cl。用如下制取装置制备过氧化钙晶体。
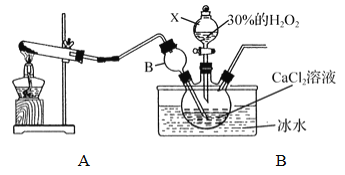
①装置A中生成的气体为________,此装置在初中化学实验中可用于制取_______(填某气体);仪器X的名称为________。
②装置C采用冰水浴控制温度在0℃左右,可能的原因主要有:
Ⅰ. 该反应是放热反应,温度低有利于提高CaO2·yH2O产率;
Ⅱ. ____________________________
③反应结束后,经过滤、洗涤、低温烘干可获得CaO2·yH2O。检验晶体已洗涤干净的方法为:取最后一次洗涤液,滴加____________,若__________,则晶体已经洗涤干净。
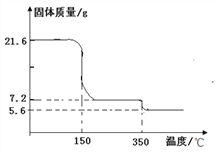
(2)为确定过氧化钙晶体的组成,某化学兴趣小组称取21.6克晶体用热分析仪对其进行热分解实验,并绘制成固体质量与温度关系图(过氧化钙晶体受热时会先失去结晶水),根据下图可知y=_______, 350℃时发生的分解反应方程式为_______________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】从微观角度上,许多化学反应都可用模拟图像来形象地表示其反应发生的过程,下图中“
 ”和“
”和“ ”分别表示不同元素的原子。下列关于图中所示反应的说法中,不正确的是
”分别表示不同元素的原子。下列关于图中所示反应的说法中,不正确的是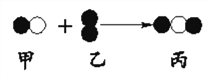
A. 该反应一定是化合反应
B. 反应中甲、乙、丙的分子个数比为2:1:2
C. 甲、丙可能都是氧化物
D. 若ag甲与bg乙充分反应一定能生成(a+b)g丙
相关试题

