①请在如右图的坐标中画出上述反应的速率与时间的关系曲线。
①请在如右图的坐标中画出上述反应的速率与时间的关系曲线。
②前4 min内,镁条与盐酸的反应速率逐渐加快,
在4 min之后,反应速率逐渐减慢,请简述其原
因 。
(2)某同学发现,纯度、质量、表面积都相同的两铝
片与H+浓度相同的盐酸和硫酸在同温同压下反应
时产生氢气的速率差别很大,铝和盐酸反应速率
更快。他决定对其原因进行探究。填写下列空白:
①该同学认为:由于预先控制了反应的其他条件,那么,两次实验时反应的速率不一样的原因,只有以下五种可能:
原因Ⅰ:Cl-对反应具有促进作用,而SO42-对反应没有影响;
原因Ⅱ:_______________________________________________________;
原因Ⅲ:Cl-对反应具有促进作用,而SO42-对反应具有阻碍作用;
原因Ⅳ:Cl-、SO42-均对反应具有促进作用,但Cl-影响更大;
原因Ⅴ:________________________________________________________。
②该同学设计并进行了两组实验,即得出了正确结论。他取了两片等质量、外形和组成相同、表面经过砂纸充分打磨的铝片,分别放入到盛有同体积、c(H+)相同的稀硫酸和盐酸的试管(两试管的规格相同)中:
a.在盛有硫酸的试管中加入少量NaCl或KCl固体,观察反应速率是否变化;
b.在盛有盐酸的试管中加入少量Na2SO4或K2SO4固体,观察反应速率是否变化。
若观察到实验a中___________________________________,实验b中______________________,则说明原因Ⅲ是正确的。依次类推。该同学通过分析实验现象,得出了结论:Cl-对反应具有加速作用。
- 答案
1―5 CBABD 6―9CBBB
10.答案:饱和溶液的物质的量浓度为: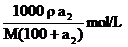
析出晶体(不含结晶水)的质量为
11.答案
(1)该反应是放热反应
2Na2O2 + 2H2O = 4NaOH + O2↑
(2)打开分液漏斗活塞使水流入试管,再将带火星的木条靠近导管口P处,木条复燃,证明有O2生成。
将导管Q浸入水中,反应过程中导管口有气泡冒出。
(3)溶液先变红后褪色。
(4)7.5%
(5)
实验操作
实验现象
结论
向盛有约2 ml 5%的H2O2溶液的试管中滴加入少量的
2 mol/L H2SO4,并把带火星的木条伸入试管。
无明显现象
起催化作用的不是SO42-
向盛有约2 ml 5%的H2O2溶液的试管中滴加入少量CuSO4溶液4,并把带火星的木条伸入试管。
试管中有大量气泡产生,带火星的木条复燃。
起催化作用的是Cu2+
12.答案
(1)药匙
(2)该混合物中肯定含有NH4HCO3,肯定不含有CuSO4 。
(3)
实验操作
预期现象和结论
向溶液B中滴加少量Ba(NO3)2溶液。
如果产生白色沉淀,说明原固体混合物中含有K2SO4;
如果没有白色沉淀产生,说明原固体混合物中不含K2SO4,(含有NaCl或NH4Cl。)
若固体混合物不含K2SO4(该句可以不写),取少量原固体混合物于试管底部, 将试管套入试管夹,用火柴点燃酒精灯,充分加热试管。
如果试管底部有固体残留,说明混合物中含有NaCl;
如果试管底部无固体残留,说明混合物中含有NH4Cl;
以下回答同样得分:
实验操作
预期现象和结论
取少量原固体混合物于试管底部,
将试管套入试管夹,用火柴点燃酒精灯,充分加热试管。
如果试管底部有固体残留,说明混合物中含有K2SO4或NaCl;
如果试管底部无固体残留,说明混合物中含有NH4Cl;
如果加热后试管底部有固体残留(该句可以不写),取残留固体加水溶解,滴加少量Ba(NO3)2溶液。
如果产生白色沉淀,说明原固体混合物中含有K2SO4;
如果没有白色沉淀产生,说明原固体混合物中含有NaCl。
13.答案
(1) ① 
图中要标明2、4、6 min时刻时的速率及要画出速率走向弧线
②镁和盐酸反应是放热反应,随着反应体系温度升高,反应速率增大;4 min后由于溶液中H+浓度降低,所以导致反应速率减小。
(2)①原因Ⅱ:Cl-对反应没有影响,而SO42-对反应具有阻碍作用;
原因Ⅴ:Cl-、SO42-均对反应具有阻碍作用,但Cl-影响更小(或SO42-影响更大)。
②反应速率加快; 反应速率减慢。
14.答案
(1) ①②④
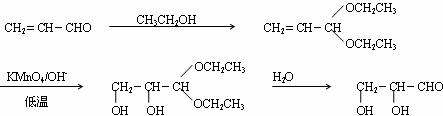
(2)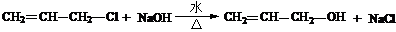
(3) 
(4) 加成反应 水解(取代)反应
(5) 
15.答案:
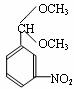
(1)
(2)C 浓硫酸有吸水性,减小水的浓度有利于平衡向右移动。
(3)