第I卷
一、选择题
题号
1
2
3
4
5
6
7
8
9
10
11
12
答案
A
B
B
C
C
B
B
B
A
B
D
13.(8分)
(1)①非极性 二氧化碳电子式略。 (各1分)
② C(s) + O2(g) = CO2(g) △H = -393.6kJ/mol 2分
(2) ① Al3+ + 4OH- =
AlO2- + 2H2O
2分
② Al3+
+ 3AlO2- + 6H2O = 4Al(OH)3↓ 2分
14.(10分)
(1)1nm~100nm(1分)
(2)Fe FeS H2SO4(稀)(3分)
(3)①H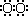 H(1分)
H(1分)
②2Fe2++H2O2+2H+=2Fe3++2H2O(2分)
(4)取少量E于试管中,用胶头滴管入NaOH溶液,加热试管,可观察到试管口处
湿润的红色石蕊试纸变蓝。(或其他合理答案)(3分)
15.(8分)
(1)K= (2分) 放热
(1分)
(2)b (1分) 1.5×10-3mol・L-1・s-1 (2分)
(3)bc (1分) (4)c (1分)
16.(10分)
方案一 (1)
保证NaHCO3全部分解 (1分)
方案二
(2)①检查装置的气密性(1分) 硫酸
(1分)
防止空气中水蒸气、CO2进入C管被吸收(1分)
② C (1分)
③需设计一将A、B中的CO2全部吹入C中吸收的气体装置(1分)
方案三
(3)①玻璃棒(1分)
②取少量滤液,再滴加BaCl2少许,如无白色沉淀说明沉淀完全(1分)
③ 51%(2分)
17.(18分)
(1)加成反应 (还原反应)(1分);
(2) CH3COOH 1分
 Br2CH― ―OOCCH3 ;
2分
Br2CH― ―OOCCH3 ;
2分
△ 
2分 ②
21.(10分) (1)加成反应 (还原反应)(2分);  (2)Br2CH―
―OOCCH3 ; CH3COOH (4分,各2分); (2)Br2CH―
―OOCCH3 ; CH3COOH (4分,各2分);
|
|
△ 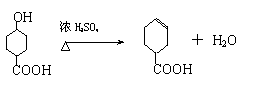  (3) ①CH3CHO+2Ag(NH3)2OH 2Ag↓+CH3COONH4+3NH3+H2O; (3) ①CH3CHO+2Ag(NH3)2OH 2Ag↓+CH3COONH4+3NH3+H2O;
②
(4分,各2分) 25.(11分) (1)CaTiO3((2分) (2)1S22S22P63S23P63d24S2或[Ar]
3d24S2
2分 d区 3d24S2 (各1分) (3)弱 1分 (4)Ti14C13 分子 熔点低、沸点低、硬度小(写出2个即可) (各1分) 29.答案.(1)蒸发结晶(或蒸发1分)
1,3,5 NaCl+NH3+H2O+CO2===NaHCO3+NH4Cl(或NH3+CO2+H2O===NH4HCO3
、NH4HCO3+NaCl===NaHCO3+NH4Cl)(1分) ②增加NH4+的浓度,有利于沉淀平衡向生成NH4Cl的方向进行,将NaHCO3转化为Na2CO3而不析出。(1分) (3)①HCl(或氯化氢)(1分) MgCl2・6H2O Mg(OH)Cl + HCl↑+5H2O(1分)
Mg(OH)Cl + HCl↑+5H2O(1分) (4)500 ; 3.8×1011C(各1分,共2分)
关闭

| | | | | |