(1)先关闭活塞a,将6.4g铜片和12mL18mol/L的浓硫酸放在圆底烧瓶中共热至反应完毕,发现烧瓶中还有铜片剩余。再打开活塞a,将气球中的氧气缓缓挤入圆底烧瓶,最后铜片完全消失。
①B是用来收集实验中产生的气体的装置,但导管未画全,请直接在原图上把导管补充完整。
②写出上述过程中烧瓶内发生反应的化学方程式: ,
。
③如何验证B瓶中收集的气体是SO2而不是H2?(写出实验过程和现象)________________________________________________。
(2)事实表明,上述反应全部结束后,硫酸仍有剩余。为定量测定余酸的物质的量浓度,甲、乙两同学进行了如下设计:
①甲同学设计的方案是:先测定铜与浓硫酸反应产生SO2的量,再通过计算确定余酸的物质的量浓度。他认为测定SO2的量的方法有多种,请你写出其中的一种
。
②乙同学设计的方案是:将反应后的溶液冷却后全部移入100mL容量瓶中并加蒸馏水定容,取20ml于锥形瓶中,用酚酞作指示剂,用标准氢氧化钠溶液进行滴定,再求出余酸的物质的量浓度。你认为乙同学设计的实验方案能否准确求得余酸的物质的量浓度 (填“能”或“否”),理由是 。
- 答案
一、单选题(78分)
1
2
3
4
5
6
7
8
9
10
11
12
13
C
D
B
A
C
A
C
B
B
D
C
A
D
二、多项选择题(48分)
14
15
16
17
18
19
20
21
D
B C
A
D
C
A C D
C
A C
22:(1)(-10cm,-5cm)(3分) 1m/s(3分)
(2) ① B , C 。(4分) ②, ③ 如图所示,(每图4分)
 |
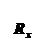
 |
23:(16分)
(1)
汽车加速冲过,设加速度为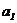
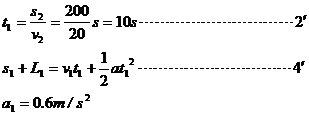
即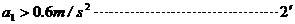
(2) 汽车减速:( 8分)
若以汽车到交叉口,火车尾过交叉口为准.
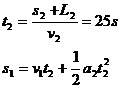
得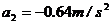
此时汽车的速度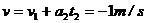
即汽车过了铁轨再返回.因此此法不行.(只计算到此步不给分)
应以汽车停在交叉口为准.
由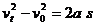 ………………………………4′
………………………………4′
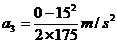
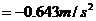 ………………………………2′
………………………………2′
即汽车减速的加速度大小 .……………2′
.……………2′
24:(18分)解.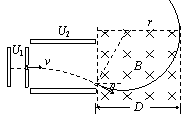 ⑴
由
⑴
由 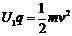 得 v =1.0×104m/s (4分)
得 v =1.0×104m/s (4分)
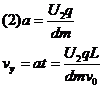
 得U2 = 100V (6分)
得U2 = 100V (6分)
⑶ 进入磁场时微粒的速度是v/=v/cos30º, (2分)
轨道半径r=2D/3, (2分)
由洛伦兹力充当向心力:
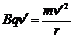
解得B至少0.20T。 (4分)
25:(20分)(1)射入第一颗子弹的过程中,根据动量守恒,
有: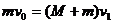 ∴v1=5m/s
(3分)
∴v1=5m/s
(3分)
此后,砂箱和弹丸向上摆动的过程中,最大高度为h,机械能守恒,有:
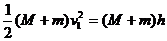
解得h=1.25m<1.6m
∴不能做完整圆周运动。 (3分)
(2)第二颗子弹射入过程中,由动量守恒,
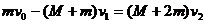 解得:
解得: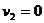 (3分)
(3分)
第三颗子弹射入过程中,
 解得
解得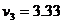 m/s
(3分)
m/s
(3分)
(3)设第n颗弹丸射入砂箱后,砂箱速度为vn,由以上分析可知:
当n是偶数时,vn=0 (1分)
当n是奇数时,由动量守恒:
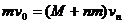 (2分)
(2分)
设射入n颗子弹后,恰好做摆角等于5o的简谐运动有:

解得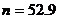 (3分)
(3分)
∴停止射击后,要使砂箱做简谐运动,则射入砂箱的子弹数目应为大于 或等于53的奇数。 (2分)
|

 Fe(OH)3+3H+ (2分)
Fe(OH)3+3H+ (2分) 
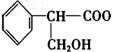
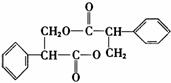
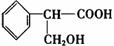
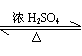
 CuSO4
+ SO2↑+ 2H2O,(2分)
CuSO4
+ SO2↑+ 2H2O,(2分)