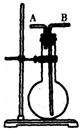
 ②瓶口插上带塞的温度计;
②瓶口插上带塞的温度计;
③加热并迅速使反应温度上升到170℃;
④气体通过稀NaOH溶液进行洗气后,用酸性KMnO4溶液检验乙烯的还原性。
据此回答下列问题:
(1)步骤①中混合乙醇和浓硫酸时应注意的问题是 。
(2)在反应液中加入河沙的原因是 。
(3)步骤②中温度计水银球的正确位置是 。
(4)加热时,使反应液温度迅速升高到I7O℃的原因是 。
(5)步骤④中.用稀NaOH溶液洗涤气体,能除去可能伴随乙烯生成的气体是 。
答案:(1)将浓硫酸缓慢加入乙醇中并不断搅拌,必要时冷却。(2)河砂对乙烯的生成有催化作用,且能防止反应中形成大量的泡沫。(3)温度计水银球应浸没于反应液中。(4)若温度在1400C,生成的主要物质是乙醚并非乙稀。(5)硫酸与乙醇发生氧化还原反应生成的CO2及SO2
- 答案

