20、(10分) 在一定温度下,在一体积固定的密闭容器中加入2 mol X和1 mol Y,发生如下反应: 2X(g) + Y(g)  a Z(g) + W(g) △H = -Q kJ・mol-1 (Q>0)
a Z(g) + W(g) △H = -Q kJ・mol-1 (Q>0)
当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;平衡后再升高温度,混合气体的平均相对分子质量减小,则
(1)温度升高,平衡常数K的值是 (填“增大”、“减小”或“不变”)。
(2)化学计量数a的值为 。
(3)有同学认为,Q1一定小于Q,你认为该结论是否正确?其理由是 。
(4)维持温度不变,若起始时向容器中加入的物质的量如下列各项,则反应达到平衡后放出的热量仍为Q1 kJ的是 (稀有气体不参与反应)。
A.2 molX、1mol Y、1molAr B.a molZ、1mol W
- 答案
 五、19、(10分)(1)
(2分)
五、19、(10分)(1)
(2分)
(2)Na+ (2分)
(3)由于HF中含有以氢键相结合的聚合氟化氢分子(HF)n (3分),(其它合理答案参考给分)
(4)Na3AlF6 (3分)
20、(10分) (1) 减小 (2分) (2) 1 (2分)
(3) 正确(1分) 2 molX和1 molY不可能完全反应 (1分)
(4) A (2分,有错不给分)
(5) 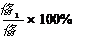 (2分)
(2分)
六、21、(10分)(1)H+ + OH― = H2O, CO32― + H+ = HCO3― (4分)
(2)224mL(2分)
(3)设碳酸钠、碳酸氢钠和氢氧化钠的物质的量分别为x、y、z,则
 x + y = 1mol/L×(0.045-0.025)L
x + y = 1mol/L×(0.045-0.025)L
z - y = 1mol/L×[0.025-(0.045-0.025)]L
x=0.01mol,y=0.01mol,z=0.015mol
所以,NaOH的质量为:0.015mol
*

