21.(8分)通常状况下,X、Y和Z是三种气态单质。X的组成元素是第三周期原子半径
最小的元素(稀有气体元素除外);Y和Z均由元素R组成,反应Y+2I-+2H+=I2+Z+H2O常作为Y的鉴定反应。
(1)Y与Z的关系是(选填字母)______________________:
a.同位素 b.同素异形体 c.同系物 d.同分异构体
(2)将Y和二氧化硫分别通入品红溶液,都能使品红褪色。简述用褪色的溶液区别二者的实验方法_______________________________________________________;
(3)举出实例说明X的氧化性比硫单质的氧化性强(用化学方程式表示)。
______________________________________________________________;
(4)气体(CN) 2与X化学性质相似,也能与H2反应生成HCN(其水溶液是是一种酸)。HCN分子中含有4个共价键,其结构式是______________________;
(5)加热条件下,足量的Z与某金属M的盐MCR3 (C为碳元素)完全反应生成CR2
和MmRn(m、n均为正整数)。若CR2质量为w
原子质量为a,则MmRn中m :n=__________________(用含wl、w2和a的代数
式表示)。
- 答案
16.(1)水 浓硫酸 ;(2)检查气密性,将G弯管浸没在盛有水的烧杯中,温热烧瓶B,观察G管口,若有气泡逸出,说明装置的气密性良好;
(3)先从A瓶逐滴滴加液体, 检验H2的纯度;(4)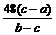 ,
, 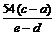 。
。
17.(1) 2Fe3++H2S
= S↓+2Fe2++2H+, Na2S+2H2O S↓+H2↑+2NaOH
S↓+H2↑+2NaOH
或S2-+2H2O S↓+H2↑+2OH-,产物NaOH可循环使用,也可得副产品H2;
S↓+H2↑+2OH-,产物NaOH可循环使用,也可得副产品H2;
(2)阳离子(Na+),钛(或石墨);
(3)4, 正四面体。
18.(1)Al(OH)3+OH---=AlO2-+2H2O ; (2)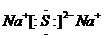 ;
;
(3)SO2+Cl2+2H2O=H2SO4+2HCl ; (4)HCl>H2S;
(5)S2->Cl ->Na+>Al3+;(6)Cl2O7(l)+H2O(l)=2HClO4(aq);△H=-4QkJ/mol。
19. (1) ①SiHCl3+H2= Si+3HClwww. Ks5 u.com
②3SiHCl3+3H2O===H2SiO3+H2↑+3HCl;高温下,H2遇O2发生爆炸。(2)ABCE
(3)生成白色絮状沉淀,又刺激性气味的气体生成。
20.
(1)NaCl; (2)Cu+2H2SO4 CuSO4+ SO2↑+2H2O,高温、催化剂; (3)CH3CH2OH。
CuSO4+ SO2↑+2H2O,高温、催化剂; (3)CH3CH2OH。
21. ⑴b ; ⑵加热褪色后的溶液,若溶液恢复红色,则原通入气体为SO2,若溶液不变红,则原通入气体是O3 ; ⑶2Fe+3Cl2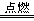 2FeCl3 Fe+S
2FeCl3 Fe+S FeS(其他合理答案均给分);
FeS(其他合理答案均给分);
⑷①H-C≡N ; ⑸16w1:(44w2-aw1)。

