17.(9分)请回答下列化工知知识.
(1)脱除天然气中的硫化氢既能减少环境污染,又可回收硫资源。硫化氢与FeCl3溶液 反应生成单质硫,其离子方程式为 ________________________________;如果用过量NaOH溶液吸收硫化氢后,以石墨作电极电解该溶液可回收硫,其电解总 反应方程式(忽略氧的氧化还原)为 __________________________________,该方法的优点是______________________________________________________;
(2)电解饱和食盐水常用离子膜电解槽和隔膜电解槽。阳离子膜和隔膜均允许通过的
分子或离子是______________,电解槽中的阳极材料为 ____________________;
(3)第ⅢA、VA元素组成的化合物GaN、GaP、CaAs等是人工合成的新型半导体材料,
其晶体结构与单晶硅相似。在GaN晶体中,每个Ga原子与____________个N原
子相连,与同一个Ga原子相连的N原子构成的空间构型为_____________。
- 答案
16.(1)水 浓硫酸 ;(2)检查气密性,将G弯管浸没在盛有水的烧杯中,温热烧瓶B,观察G管口,若有气泡逸出,说明装置的气密性良好;
(3)先从A瓶逐滴滴加液体, 检验H2的纯度;(4)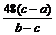 ,
, 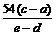 。
。
17.(1) 2Fe3++H2S
= S↓+2Fe2++2H+, Na2S+2H2O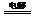 S↓+H2↑+2NaOH
S↓+H2↑+2NaOH
或S2-+2H2O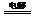 S↓+H2↑+2OH-,产物NaOH可循环使用,也可得副产品H2;
S↓+H2↑+2OH-,产物NaOH可循环使用,也可得副产品H2;
(2)阳离子(Na+),钛(或石墨);
(3)4, 正四面体。
18.(1)Al(OH)3+OH---=AlO2-+2H2O ; (2)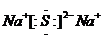 ;
;
(3)SO2+Cl2+2H2O=H2SO4+2HCl ; (4)HCl>H2S;
(5)S2->Cl ->Na+>Al3+;(6)Cl2O7(l)+H2O(l)=2HClO4(aq);△H=-4QkJ/mol。
19. (1) ①SiHCl3+H2= Si+3HClwww. Ks5 u.com
②3SiHCl3+3H2O===H2SiO3+H2↑+3HCl;高温下,H2遇O2发生爆炸。(2)ABCE
(3)生成白色絮状沉淀,又刺激性气味的气体生成。
20.
(1)NaCl; (2)Cu+2H2SO4 CuSO4+ SO2↑+2H2O,高温、催化剂; (3)CH3CH2OH。
CuSO4+ SO2↑+2H2O,高温、催化剂; (3)CH3CH2OH。
21. ⑴b ; ⑵加热褪色后的溶液,若溶液恢复红色,则原通入气体为SO2,若溶液不变红,则原通入气体是O3 ; ⑶2Fe+3Cl2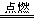 2FeCl3 Fe+S
2FeCl3 Fe+S FeS(其他合理答案均给分);
FeS(其他合理答案均给分);
⑷①H-C≡N ; ⑸16w1:(44w2-aw1)。

