15.(14分)某兴趣小组同学为证明NaOH溶液与稀盐酸发生了中和反应,从不同角度设计了如下实验方案,并进行实验。
方案一:先用pH试纸测定NaOH溶液的pH,再滴加盐酸,并不断振荡溶液,同时测定混合溶液的pH,如果测得的pH逐渐变小且小于7,则证明NaOH溶液与稀盐酸发生了化学反应。
(1)用pH试纸测定溶液的pH时,正确的操作是:
。
(2)简述强调“测得的pH小于
。
方案二:先在NaOH溶液中滴加几滴酚酞溶液,溶液显红色,然后再滴加盐酸,可观察到红色逐渐消失,则证明NaOH溶液与稀盐酸发生了化学反应。
该组同学在向NaOH溶液中滴加酚酞溶液时,发现了一个意外现象:氢氧化钠溶液中滴入酚酞溶液,溶液变成了红色,过了一会儿红色就消失了。该小组对这种意外现象的原因作了如下猜想:
①可能是酚酞溶液与空气中的氧气反应,使红色消失;
②可能是氢氧化钠溶液与空气中的二氧化碳反应,使红色消失。
(1)为验证猜想①,该组同学将配制的氢氧化钠溶液加热,并在液面上方滴一些植物油,然后在冷却后的溶液中滴入酚酞溶液。实验中“加热”和“滴入植物油”目的是 。实验结果表明酚酞溶液红色消失与空气中的氧气无关。
(2)为验证猜想②,该组同学做了如下实验:取了一定量的Na2CO3溶液,在其中滴入酚酞溶液,发现溶液也呈现红色。请用离子方程式解释这一现象产生的原因:
。
由此说明酚酞溶液红色消失与空气中的二氧化碳无关。
(3)该小组同学通过查阅资料得知:当氢氧化钠溶液浓度大于2mol/L时,就会出现上述意外现象。请设计实验证明该方案中取用的NaOH溶液浓度过大:
。
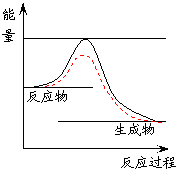
方案三:化学反应中通常伴随有能量的变化,可借助反应前后的温度变化来判断反应的发生。如果NaOH溶液与稀盐酸混合前后温度有变化,则证明发生了化学反应。
- 答案
一、单项选择题(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意)
1.D 2.C 3.B 4.D 5.C 6.A 7.B 8.D
二、不定项选择题(本题包括6小题,每小题4分,共24分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分)
9.CD 10.AD 11.D 12.C 13.BC 14.D
三、(本题包括1小题,共14分)
15.
方案一:
(1)在白瓷板或玻璃片上放一小片pH试纸,将被测液滴到试纸上,把试纸显示的颜色与标准比色卡比较
(2)排除因盐酸的加入,稀释氢氧化钠溶液而引起pH减小
方案二:
(1)赶走溶液中少量氧气,隔绝氧气
 (2)CO32―+H2O HCO3―+OH―
(2)CO32―+H2O HCO3―+OH―
(3)做对比实验,取上述NaOH溶液稀释,加入酚酞溶液出现红色且不褪去
方案三:
(1)7 (2)U形管中左边液面下降
(每空2分,共14分)
四、(本题包括2小题,共18分)
16.
⑴ 

⑵CO2+2AlO2-+3H2O=2Al(OH)3↓+CO32-
⑶Al4SiC4+2N2 4AlN+SiC+
4AlN+SiC+
⑷可行,该反应是一个焓减、熵略大于0的反应,能自发进行
(每空2分,共8分)
17.
⑴ CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4
生成的CaCO3溶解度小于CaSO4有利于反应向正向进行。
⑵)BCD ⑶CO2 ⑷ABD(每空2分,共10分)
 五、(本题包括1小题,共10分)
五、(本题包括1小题,共10分)
18.
⑴见图示(2分 ,其中过渡元素涂对得1分)
⑵  ⑶ r(Cl-)>r(K+)
⑶ r(Cl-)>r(K+)
⑷ ②④ (5) 
(除⑴外其余每空2分,共10分)
 六、(本题包括1小题,共10分)
六、(本题包括1小题,共10分)
19.
⑴①增大压强 t3~t4 ②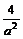
⑵①如图 ②适当增大压强,研究新催化剂
(每空2分,共10分)
七、(本题包括1小题,共8分)
20.
⑴ 2 第2周期第VIA族 (各1分,共2分)
⑵1s22s22p63s23p63d64s2
⑶H+ + AlO2-
+ H2O Al(OH)3
Al(OH)3 Al3+ + 3H2O
Al3+ + 3H2O
⑷4Fe(OH)2 + 2H2O+ O2=4Fe(OH)3
(除⑴外其余每空2分,共8分)
八、(本题包括1小题,共12分)
21.
⑴-80kJ・mol―1
⑵用过量的稀硫酸溶解过量的镁,不断搅拌,过滤,洗净、干燥
⑶加快反应速率,促进平衡向水解的方向移动
⑷取少量洗涤液,在其中加入AgNO3(或BaCl2),无沉淀生成则说明无相应离子。
Ag++Cl-=AgCl↓ Ba2++SO42-=BaSO4↓
(每空2分,共8分)
Ⅲ 1.5mol/L(4分,分步给分)

