(5)
20(12分)由于MnO2能作H2O2溶液分解的催化剂,某校化学兴趣小组想探究其他一些金属氧化物是否也可以作H2O2溶液分解的催化剂,请你参与他们的探究过程。
(1)[猜想]:Al2O3能作过氧化氢分解的催化剂。
(2)[实验验证]:
实验步骤
实验现象
实验结论
实验一
将带火星的木条伸入装有过氧化氢溶液的试管中
木条不复燃
实验二
①
②
木条复燃
Al2O3能加快H2O2溶液的分解速率
(3)[结论]:故Al2O3能作H2O2溶液分解的催化剂。
(4)[讨论与反思]:有的同学认为只有上述两个实验,不能完全证明Al2O3在H2O2溶液分解中起了催化作用。还应补充一个上述反应前后Al2O3质量是否改变的探究实验。
实验三:①准确称量Al2O3(少量)的质量;②完成实验二;③待反应结束后,将实验二试管里的物质进行 、洗涤、干燥,然后④ 。
(5)有同学认为,即使实验三中Al2O3在反应前后质量不变,要证明猜想,上述三个实验还不足够证明,仍需要再增加一个探究Al2O3 的实验。
- 答案
一、选择题(16×3分=48 分)
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
答案
D
A
C
D
B
B
A
B
D
D
C
A
D
B
C
B
二、第II卷(非选择题 共52分)
17.(共7分,方程式2分,其余每空1分)
(1)①将石蕊试纸湿润 ②检验容量瓶是否漏水
(2)过量的CO2 CO2+Na CO
CO +H2O=2NaHCO3
+H2O=2NaHCO3
(3)氨水 Ag(NH3)2Cl
18.(10分,方程式3分,其余每空2分)
(1)H2O2的电子式 (2离子晶体
(3)HSO3― + H+ = SO2 ↑ + H2O
(4)2NaClO = 2NaCl + O2↑
19.(14分) (1)FeS2 (1分) O3和O2 (1分)
(2) 离子键 非极性共价键 (2分) O=C=O (1分)
(3)①②③ (3分)
(4)2Fe3++SO2十2H2O=SO42-十2Fe2++4H+ (2分)
Na2CO3+SiO2 Na2SiO3+CO2↑ (2分)
Na2SiO3+CO2↑ (2分)
(5) 0.2mol (2分)
20.(12分)实验一 在常温下H2O2分解少或不分解 (2分)
实验二 ①在实验一中加少量的Al2O3 (2分)
② 将带火星的木条置于试管口(2分)
(4) 过滤 (1分) 称量Al2O3的质量 (1分)
(5) 化学性质是否改变 (1分)
(6) 产生气泡速率快慢 (1分) 控制阴离子相同,排除干扰 (1分)
将FeCl3改为Fe2(SO4)3 (1分)
21.(9分) (1)
(3)盐酸的物质的量浓度 (2分)
(4)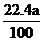 <
V(CO2)<
<
V(CO2)<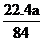 (3分)
(3分)

