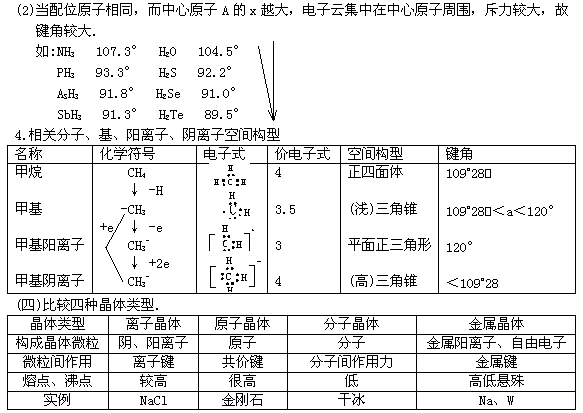
 (2)晶体熔、沸点高低的比较
(2)晶体熔、沸点高低的比较 w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
一般规律:原子晶体>离子晶体>分子晶体。
① 离子晶体:离子晶体的晶格能越大,则离子键越强,晶体熔、沸点越高。
晶格能比较:阴、阳离子所带电荷越多,半径越小,则晶格能越大。
例如:MgO>NaCl(Mg2+半径小,所带电荷多)。
FeO>NaCl(Fe2+与Cl?电子层数相同,O2?与Na+电子层数相同,但FeO中离子所带电荷数多)
② 分子晶体:组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越强,晶体的熔、沸点越高。
例如:F2<Cl2<Br2<I2。
此外,当分子形成分子间氢键时,分子晶体的熔、沸点升高。
例如:NH3、H2O、HF的熔、沸点均比同主族下一周期的氢化物来的高。
③ 原子晶体:原子半径越小,键长越短,键能越大,键越牢固,晶体的熔、沸点越高。
例如:金刚石>二氧化硅>金刚砂>晶体硅。
④ 金属晶体:金属离子所带电荷越多,半径越小,金属键越强,晶体的熔、沸点越高。
例如:Na<Mg<Al。
(3)晶体化学式的确定
① 分子结构:分子结构中每一个微粒均属于该分子,按结构中的微粒数书写的式子即为其化学式。
② 晶体结构
分摊法:按晶体结构中各微粒对结构单元的贡献计算出的微粒数目的最简整数比书写的式子即为其化学式。
紧邻法:按晶体结构中各微粒周围与之距离最近且相等的另一微粒数目的最简整数比书写的式子即为其化学式。
(4)金属晶体
① 金属的导电性、导热性和延展性均与自由电子有关。
② 金属晶体的堆积方式
六方堆积(Mg、Zn等):配位数为12;面心立方堆积(Al、Cu等):配位数为12;
体心立方堆积(Na、K等):配位数为8。
- 答案

