22.(10分)海带经灼烧完全成灰,灰分中含有 等成分。某化学课外小组要从海带中提取少量的碘。
等成分。某化学课外小组要从海带中提取少量的碘。
他们的操作是:①取一定量海带,剪碎后经灼烧完全成灰;②将海带灰转移到小烧杯中,再向小烧杯中加100 mL蒸馏水,搅拌,煮沸2 - 3 min,使可溶物溶解;③过滤,向滤液中加入少量新制的饱和氯水;④向上述反应后的滤液中加入10mL某萃取剂,用力振荡后静置;⑤分液。
试据此回答有关问题
(1)③中发生反应的离子方程式为______________________________________。
(2)④操作中选用的萃取剂可以是_______
A.酒精 B.苯 C.氢氧化钠溶液 D.直馏汽油
此步操作中也可选用CCl4做萃取剂,其主要原因是____________________________
_______________________________________________________________________
若将CCl4加入到滤液中,充分静置后主要现象是______________________________
(3)第⑤操作中,要用到的主要玻璃仪器是_____________;分液时要将漏斗上口的玻璃塞打开或使上凹槽或小孔对准漏斗口上的小孔,其目的是
_____________________________________________
旋开活塞用烧杯接受液体操作时,应注意的问题是_______________________
(4)要从萃取剂中分离出碘,所用分离方法的名称是_______
- 答案
一、选择题
题号
1
2
3
4
5
6
7
8
9
10
答案
C
D
A
B
A
B
D
B
D
B
二、选择题
题号
11
12
13
14
15
答案
D
C
BD
C
B
三、填空、简答和计算
16.(1)酒精或氢氧化钠溶液 (2)稀盐酸或稀硝酸 (3)浓盐酸
17.(1)生成淡黄色沉淀 (2)分层,下层橙红色 (3)生成白色沉淀
18. Cl2、Br2、I2、HClO; KCl、I2; KCl
19.(1)
MnO2+ 4HCN 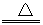 Mn(CN)2+(CN)2↑+2H2O(2)(CN)2+2KOH==KCN+ KCNO+ H2O
Mn(CN)2+(CN)2↑+2H2O(2)(CN)2+2KOH==KCN+ KCNO+ H2O
20.(1)NH4I>NH4Br>NH4Cl>NH
21. HCl MnO2 Cl2 KBr KCl Br2 KI I2 AgBr
22.(1)2I-+Cl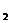 ====2Cl-+I
====2Cl-+I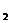 (2)BD;四氯化碳不溶于水、碘在其中有较好的溶解度、且四氯化碳易挥发;分层,下层为紫红色,上层近于无色。(3) 使漏斗内外空气相通,以保证漏斗里液体能流出;使漏斗下端管口紧靠烧杯内壁,及时关闭活塞,不要让上层液体流出;(4)蒸馏
(2)BD;四氯化碳不溶于水、碘在其中有较好的溶解度、且四氯化碳易挥发;分层,下层为紫红色,上层近于无色。(3) 使漏斗内外空气相通,以保证漏斗里液体能流出;使漏斗下端管口紧靠烧杯内壁,及时关闭活塞,不要让上层液体流出;(4)蒸馏
23.设参加反应的Cl2的质量为x,
2NaI+Cl2==2NaCl+I
300 71 117 300-117
x
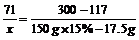 x=
x=
答:有
24.解:Cl2+2KBr=2KCl+Br2 ∵K+:Cl-=2:1
∴KBr过量有剩余且生成的KCl物质的量等于KBr剩余的物质的量。
又∵Br元素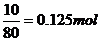
则:KBr剩余0.125mol,生成KCl0.125mol
(1)V(Cl)2 =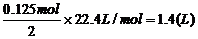 (2)
(2)