36.如果给原子核外的电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:A、原子核对核外电子的吸引力 B、形成稳定结构的倾向。
下表是一些主族元素气态原子失去核外不同电子所需的能量(kJ/mol )
锂
X
Y
失去第一个电子
519
502
580
失去第二个电子
7296
4570
1820
失去第三个电子
11799
6920
2750
失去第四个电子
9550
11600
(1)通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量
(2)表中X可能为 元素(填写字母)。
A.H B.Be C.Na D.Si E. S
(3)Y可能是元素周期表中 族元素,你判断的依据是____________________
- 答案
一、选择题
题号
1
2
3
4
5
6
7
8
9
10
答案
C
B
D
D
C
D
C
C
B
B
二、选择题
题号
11
12
13
14
15
16
17
18
19
20
答案
D
A
D
C
D
B
D
D
A
C
三、选择题
题号
21
22
23
24
25
26
27
28
29
30
答案
BC
BD
BD
D
B
C
C
A
BC
BD
题号
31
32
33
34
答案
BC
B
AB
D
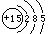 四、填空、简答和计算
四、填空、简答和计算
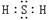 35. (1)
(2)
35. (1)
(2)
 |
(3)
(4)BaCO3+2H+==Ba2++CO2↑+H2O
 |
 (5)Cu+2H2SO4(浓)===CuSO4+SO2↑+2H2O
(5)Cu+2H2SO4(浓)===CuSO4+SO2↑+2H2O
36.(1)Li 原子失去一个电子后, Li+已经形成了稳定结构,此时再失去电子很困难。
(2) C ;(3) ⅢA族,失去第四个电子时所需能量远远大于失去前三个电子所需能量 。
37.(1)产生白色沉淀,试液变成红色;因为在水中SO2和Cl2反应生成盐酸和硫酸,使石蕊试液变红色,硫酸与BaCl2溶液反应产生BaSO4 沉淀。 (2)③、SO3;②、HCl;①、SO2;③、H2O。
38.(14分)(1)碳、氧、钠、硫(2)CO2+2OH-=H2O+CO32-
(3)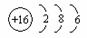
 。
。
39.⑴SiO2 Na2SiO3 H2SiO3
⑵
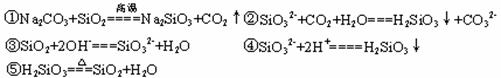
40.(1)
含有SO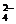 或SO
或SO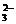 中的一种或两种都有。
中的一种或两种都有。
(2) BaCO3;(3)
Br-、S2-
; HCO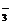 (除SO
(除SO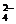 或SO
或SO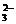 以外)
以外)
41.(1)Al;H2 ;Cl2(2)非金属;
(3)氧化物或氢化物;SiO2+ Si+2CO↑或O2+H2S
Si+2CO↑或O2+H2S 2H2O+S(其它合理答案均可)
2H2O+S(其它合理答案均可)
42.(1)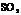 、
、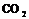 ;
;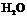 (2)
(2)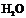 ;
;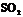 、
、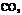 (3)
(3)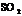 、
、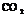 ;
;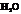
43.解: 0.5molY的离子得到6.02×1023个电子(即1mol电子)被还原为中性原子,所以1molY应得到2mol电子还原为中性原子,即Y离子应带2个带电荷,则其氧化物的化学式应为YO。
YO + 2HCl=YCl2+H2O
(Y+16)g 2mol
∴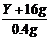 =
=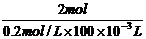
∴Y=24
又∵Y核中质子数等于中子数,∴Y的质子数为12,应是Mg,位于第三周期ⅡA族。
MgO+2H+=Mg2++H2O
44.解: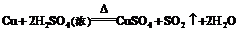
由方程式可知: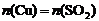 =n(被还原的
=n(被还原的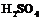 )
)
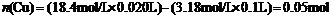
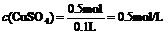
45. (1)a≤2/3;(2)a≥2; (3) 2/3<a<2, (1?a/2)mol

