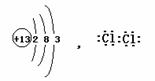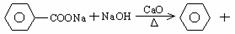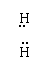52.2
该课题组根据表中数据,设计了污水处理方案,拟利用该厂的废铁屑(有少量锈斑)、
烧碱溶液和硫酸处理此污水,回收FeSO4・7H2O和Ag。
(1)请填写下列空白,完成得到Ag的实验方案:
①将有锈斑的废铁屑先后用热的烧碱溶液和热水进行洗涤,目的是 ;
②将工厂废水过滤,用少量水洗涤滤渣,洗涤液并入滤液后保留待用;
③ ,目的是使Ag+全部还原为金属Ag;
④ ,目的是分离出Ag;
(2)请写出后续的步骤,除去Al3+,得到比较纯净的FeSO4・7H2O晶体:
⑤将第 步与第④步所得滤液混合后,加入少量硫酸至混合液的pH为3~4,
滤出FeSO4・7H2O晶体;
⑥
得到较纯净的FeSO4・7H2O晶体。
(3)步骤②中能否用变通自来水洗涤滤渣? (填“能”或“否”),理由是
(4)步骤③中有关化学反应的离子方程式是
(5)在步聚⑤中,加少量硫酸调整pH的目的是 。
- 答案
1.(16分)
(1)①洗去油污(1分);③在②的滤液中加入稍过量的洗涤过的废铁屑,充分反应后过滤(1分);④将③的滤渣溶入足量的稀硫酸中,过滤,滤液保留待用(1分);(2)⑤、③(1分),将溶液加热到
(3)否(1分),普通自来水中含Cl―,使Ag+被沉淀(1分)。 (共2分)
(4)Fe+2Ag+
Fe2++2Ag,Fe2O3+6H+ 2Fe3++3H2O,Fe+2Fe3+ 3Fe2+,
Fe+2H+ Fe2++H2↑
(各1分,共4分)
(5)抑制Fe2+的水解,防止Fe2+被氧化 (2分)
2.(10分)(1)MnO2, NaOH溶液 (各1分) (共2分)
(2)2NaOH+Cl2==== NaCl+NaClO+H2O (2分)
(3)①不能(1分),HCl气体进入C中,消耗NaOH, 降低NaClO的纯度。(2分)(共3分)
|