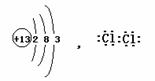1.(16分)
(1)①洗去油污(1分);③在②的滤液中加入稍过量的洗涤过的废铁屑,充分反应后过滤(1分);④将③的滤渣溶入足量的稀硫酸中,过滤,滤液保留待用(1分);(2)⑤、③(1分),将溶液加热到50℃~80℃,蒸发浓缩,冷却结晶(2分);⑥在烧杯里加入适量水,然后加入研细的所得到的FeSO4・7H2O晶体,同时加入少量硫酸至pH 3~4,加热到50℃~80℃,趁热过滤,冷却至室温(2分)。
(3)否(1分),普通自来水中含Cl―,使Ag+被沉淀(1分)。 (共2分)
(4)Fe+2Ag+
Fe2++2Ag,Fe2O3+6H+ 2Fe3++3H2O,Fe+2Fe3+ 3Fe2+,
Fe+2H+ Fe2++H2↑
(各1分,共4分)
(5)抑制Fe2+的水解,防止Fe2+被氧化 (2分)
2.(10分)(1)MnO2,
NaOH溶液 (各1分) (共2分)
(2)2NaOH+Cl2====
NaCl+NaClO+H2O (2分)
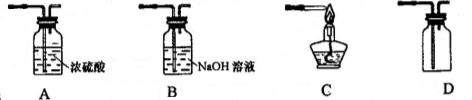
(3)①不能(1分),HCl气体进入C中,消耗NaOH, 降低NaClO的纯度。(2分)(共3分)
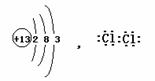
3.(12分)(1)(1分)检查装置的气密性 (2)(1分)< (2分)Zn+CuSO4=ZnSO4+Cu置换出铜形成原电池加快反应进行。 (3)(2分)产生黄色(乳白色)浑浊 (4)(2分)H2S+2NaOH=Na2S+2H2O (5)(2分)维持圆底烧瓶和分液漏斗中压强一致,使分液漏斗中液体能顺利滴下。 (6)(2分)①
. . ③4NH3+5O2
4NO+6H2O(1分) ④3Cu+8H++2NO3― 3Cu2++2NO↑+4H2O(1分) ⑤Na2O2(1分),NO2(1分) 5.(1)关闭a,从球形漏斗口注水,待水从漏斗管上升与容器内的水面形成一段水柱差,停止加水,静置乍刻如水柱差不下降,证明其气密性良好,可以使用(3分)
△ △ (5)Fe2O3+3H2 2Fe+3H2O FeO+H2 Fe+H2O(2分) (6)16(2分) (7)防止空气中的H2O蒸气等气体进入E中(2分) 偏大(2分) 偏小(2分)
关闭

| | | | | | | |